
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.C原子在同周期原子中半径最大(稀有气体除外),E与C位于不同周期,E原子核外最外层电子数与C相同,E各层电子均充满,则C处于IA族;E为过渡元素,原子核外电子数为2+8+18+1=29,则E为Cu;B元素的第一电离能比同周期相邻两种元素都大,B处于ⅡA族或ⅤA族,A与B同周期、A与D同族,则A处于第二周期、D处于第三周期,A原子核外有两个未成对电子,最外层电子排布为2s22p2或2s22p4,而A的原子序数小于B,可推知A为碳元素,故B为N元素、D为Si,C的原子序数大于氮,可推知C为Na,据此解答.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大.C原子在同周期原子中半径最大(稀有气体除外),E与C位于不同周期,E原子核外最外层电子数与C相同,E各层电子均充满,则C处于IA族;E为过渡元素,原子核外电子数为2+8+18+1=29,则E为Cu;B元素的第一电离能比同周期相邻两种元素都大,B处于ⅡA族或ⅤA族,A与B同周期、A与D同族,则A处于第二周期、D处于第三周期,A原子核外有两个未成对电子,最外层电子排布为2s22p2或2s22p4,而A的原子序数小于B,可推知A为碳元素,故B为N元素、D为Si,C的原子序数大于氮,可推知C为Na.
(1)E为Cu,原子核外电子排布式是:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)B为N元素,的最高价含氧酸根为NO3-,N原子价层电子对数为3+$\frac{5+1-2×3}{2}$=3,没有孤电子对,空间结构为平面三角形,
故答案为:平面三角形;
(3)同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:N>C>Si,
故答案为:N>C>Si;
(4)晶体硅与SiC均属于原子晶体,晶体硅中的Si-Si键比Si-C键长,键能低,所以晶体硅熔点低,
故答案为:低;晶体硅与SiC均属于原子晶体,晶体硅中的Si-Si键比Si-C键长,键能低,所以晶体硅熔点低;
(5)已知碳、Na和地壳中含量最多的元素按1:1:2的原子个数比可形成某离子化合物为Na2C2O4,该化合物能使酸性高锰酸钾溶液褪色,反应生成二氧化碳、锰离子与水,发生反应的离子方程式为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,
故答案为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O.
点评 本题是对物质结构的考查,涉及核外电子排布、微粒结构、电负性、晶体类型与性质、氧化还原反应等,注意掌握熔沸点高低比较,难度中等.


科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
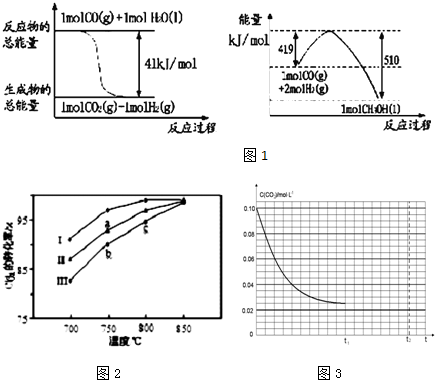
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
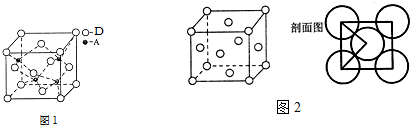
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
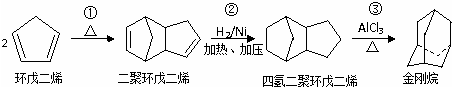
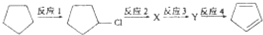
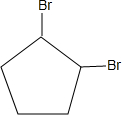 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$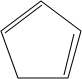 +2NaBr+2H2O;
+2NaBr+2H2O;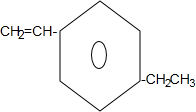 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI溶液中滴加稀硫酸:4H++4I-+O2=2I2+2H2O | |
| B. | 过量SO2通入氨水中:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C. | NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3↓ | |
| D. | 氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 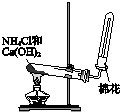 用a制备并收集氨气 | B. | 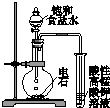 用b制备并检验乙炔 | ||
| C. | 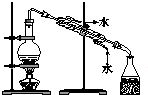 用c蒸馏海水得到淡水 | D. | 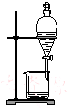 用d分离Na2CO3溶液与CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:5 | D. | 6:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有强氧化性 |
| B | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有较多水 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向AgCl悬浊液中滴加KI溶液 | 白色沉淀变黄色 | AgI的溶解度大于AgCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com