
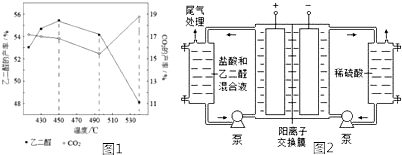
分析 (1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),反应热也进行相应计算,平衡常数为反应Ⅱ与Ⅰ的平衡常数的商;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气;
(4)阳极液中盐酸的作用,除了产生氯气外,还有增强溶液导电性;
(5)通过总电量为60ta C,再计算电极上通过电子总物质的量;计算生成乙醛的物质的量,根据C元素化合价变化计算消耗电子物质的量,电解中的电流效率.
解答 解:(1)在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,硝酸被还原为NO,反应方程式为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O,
故答案为:3CH3CHO+4HNO3$\stackrel{Cu(NO_{3})_{2}}{→}$3OHC-CHO+4NO↑+5H2O;
(2)①已知:Ⅰ.OHC-CHO(g)+2H2(g)?HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
Ⅱ.2H2(g)+O2(g)?2H2O(g)△H=-484kJ•mol-1 K2
根据盖斯定律,Ⅱ-Ⅰ可得:HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g),则△H=-484kJ•mol-1-(-78kJ•mol-1)=-406kJ•mol-1,平衡常数K反应Ⅱ与Ⅰ的平衡常数的商,即K=$\frac{{K}_{2}}{{K}_{1}}$,
故答案为:-406;$\frac{{K}_{2}}{{K}_{1}}$;
②主反应HOCH2CH2OH(g)+O2(g)?OHC-CHO(g)+2H2O(g)为放热反应,升高温度平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物,使乙二醛产率降低,
故答案为:升高温度,主反应平衡逆向移动;温度超过495℃时,乙二醇大量转化为二氧化碳等副产物;
(3)阴极是氢离子放电生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(4)阳极液中盐酸可以增强溶液导电性,
故答案为:增强溶液导电性;
(5)电极通过总电量为60t s×a A=60ta C,则电极上通过电子总物质的量=$\frac{60ta}{f}$mol;生成乙醛酸的物质的量为$\frac{mg}{74g/mol}$=$\frac{m}{74}$mol,醛基转化为羧基,C原子化合价升高2价,消耗电子物质的量2×$\frac{m}{74}$mol,故电解中的电流效率η=$\frac{2×\frac{m}{74}mol}{\frac{60ta}{f}}$×100%=$\frac{5mf}{111at}$%,
故答案为:$\frac{5mf}{111at}$%.
点评 本题考查化学平衡常数计算、运用盖斯定律计算反应热、陌生方程式的书写、电极原理应用等,(5)中计算为易错点,关键是确定C元素化合价变化,可以利用碳元素平均化合价计算,注意电子转移守恒在电化学计算中应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑧ | B. | ③④⑤⑥ | C. | ②④⑤⑦⑧ | D. | ②④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
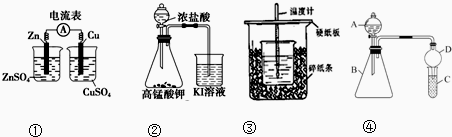
| A. | 装置①:检验电流的方向 | |
| B. | 装置②:探究氧化性:KMnO4>Cl2>I2 | |
| C. | 装置③:测定中和热 | |
| D. | 装置④:A、B、C中分别加入HCl、Na2CO3、Na2SiO3判断Cl、C、Si的非金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4的空间构型是正四面体 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 | |
| D. | SO2、SO3都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 淀粉与20%的硫酸混合液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性 |
| C | 溴乙烷与NaOH溶液共热充分反应后,再加入AgNO3溶液,能观察到浅黄色沉淀 | 对,溴乙烷水解产生了溴离子 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
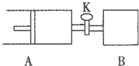 如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )| A. | 反应速率:v(B)>v(A) | |
| B. | A容器中X的转化率为80% | |
| C. | 平衡时的压强:PB=PA | |
| D. | 平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②④⑤ | C. | ③④⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 在氧气中点燃Mg条 | 发出耀眼白光,生成白色固体 |
| B | 将乙烯通入酸性高锰酸钾溶液 | 溶液褪色 |
| C | 将点燃的Na块伸入Cl2瓶中 | Na块剧烈燃烧,生成大量黑烟 |
| D | 将碘水滴到新切的土豆片上 | 土豆片表面变蓝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com