
【题目】某校学习小组的同学设计用分子筛催化CH4还原NO2并检验还原产物。回答下列问题:
(1)甲组同学设计用如图所示装置分别制备CH4和NO2。
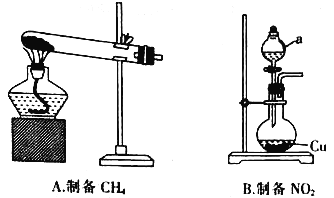
①在加热条件下,无水CH3 COONa与NaOH(CaO为催化剂)生成CH4和Na2CO3的化学方程式为___________。
②仪器a的名称为__________,仪器a中的药品是__________(填名称)。__________(填“能”或“不能”)用铁代替圆底烧瓶中的铜。
(2)乙组同学利用甲组制得的干燥气体并利用下列装置用CH4还原NO2
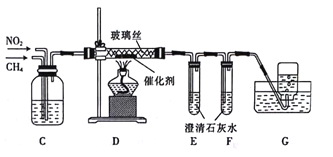
①C装置的作用是______________(列举2点)。
②D装置反应管中盛放玻璃丝的目的是___________;CH4与NO2生成N2和CO2的化学方程式为_____________。
③E装置中澄清石灰水未变浑浊,F装置中澄清石灰水变浑浊,其原因可能是__________。
【答案】CH3COONa+NaOH![]() CH4↑+Na2CO3 分液漏斗 浓硝酸 不能 混合CH4和NO2、调节CH4和NO2的比例(或控制反应的速率) 防止气体将催化剂吹入导管,造成堵塞 CH4+2NO2
CH4↑+Na2CO3 分液漏斗 浓硝酸 不能 混合CH4和NO2、调节CH4和NO2的比例(或控制反应的速率) 防止气体将催化剂吹入导管,造成堵塞 CH4+2NO2![]() N2+CO2+2H2O E中二氧化碳过量,反应生成了碳酸氢钙
N2+CO2+2H2O E中二氧化碳过量,反应生成了碳酸氢钙
【解析】
(1)①根据在加热条件下,无水CH3 COONa与NaOH(CaO为催化剂)生成CH4和Na2CO3书写反应的化学方程式;②根据装置图结合常见仪器的结构解答;实验室可以使用浓硝酸与铜反应制备二氧化氮,铁在常温下遇到浓硝酸发生钝化,据此分析解答;
(2)①在C装置中将CH4和NO2混合均匀,并可以通过气泡的速度调节CH4和NO2的比例和反应速率;②D装置中气体可能将催化剂吹入导管,造成堵塞;CH4与NO2生成N2和CO2,结合质量守恒判断其余生成物,再书写反应的化学方程式;③二氧化碳与澄清石灰水反应生成碳酸钙,若二氧化碳过量,生成的碳酸钙被转化为碳酸氢钙而溶解,据此分析解答。
(1)①在加热条件下,无水CH3 COONa与NaOH(CaO为催化剂)生成CH4和Na2CO3的化学方程式为CH3COONa+NaOH![]() CH4↑+Na2CO3,故答案为:CH3COONa+NaOH
CH4↑+Na2CO3,故答案为:CH3COONa+NaOH![]() CH4↑+Na2CO3;
CH4↑+Na2CO3;
②根据装置图,仪器a为分液漏斗,实验室可以使用浓硝酸与铜反应制备二氧化氮,因此仪器a中的药品为浓硝酸,铁在常温下遇到浓硝酸发生钝化,不能用铁代替圆底烧瓶中的铜,故答案为:分液漏斗;浓硝酸;不能;
(2)①在C装置中将CH4和NO2混合均匀,并可以通过气泡的速率调节CH4和NO2的比例,也可以控制反应的速率,故答案为:混合CH4和NO2;调节CH4和NO2的比例(或控制反应的速率);
②D装置反应管中盛放玻璃丝可以防止气体将催化剂吹入导管,造成堵塞;CH4与NO2生成N2和CO2,反应的化学方程式为CH4+2NO2![]() N2+CO2+2H2O,故答案为:防止气体将催化剂吹入导管,造成堵塞;CH4+2NO2
N2+CO2+2H2O,故答案为:防止气体将催化剂吹入导管,造成堵塞;CH4+2NO2![]() N2+CO2+2H2O;
N2+CO2+2H2O;
③二氧化碳与澄清石灰水反应生成碳酸钙,若二氧化碳过量,生成的碳酸钙被转化为碳酸氢钙而溶解,因此可能造成E装置中澄清石灰水未变浑浊,故答案为:E中二氧化碳过量,生成了碳酸氢钙。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。
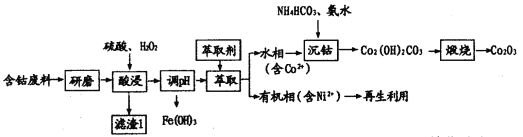
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_________________________________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
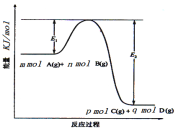
该反应△H =____(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题:
①该反应的ΔH=__________填“>”、“=”或“<”)。
②已知在一定温度下,C(s) +CO2 (g)![]() 2CO(g)平衡常数K1;C (s) +H2O (g)
2CO(g)平衡常数K1;C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
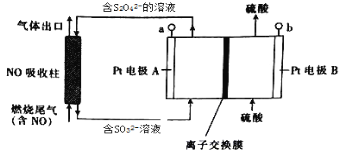
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
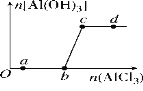
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,请按要求填空:
A | B | C | |||||||||||||||
D | E | F | G | ||||||||||||||
H | I | ||||||||||||||||
(1)A元素的最高价氧化物的电子式______。
(2)元素G在周期表中的位置是_______。
(3)C与D简单离子中半径较大的是________(用离子符号表示)。
(4)C与F的气态氢化物中较稳定是________(用化学式表示)。
(5)写出G单质与I的最高价氧化物对应水化物的溶液反应的化学方程式______。
(6)下列说法或实验不能证明H和I两种元素的金属性强弱的是_____。
a 比较两种元素的单质的熔点、沸点高低
b 将两种元素的单质分别与冷水反应,观察反应的剧烈程度
c 比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
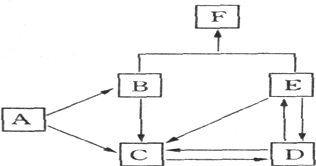
据此,请回答下列问题:
(1)写出以下物质的化学式:A________,D______,F__________。
(2)写出下列变化的化学方程式:
B→C______________________________________________
E→C______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
D. CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com