
【题目】CO2可转化成有机物实现碳循环。在容积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
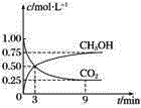
(1)从3 min到9 min,v(H2)=________ mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填字母)。
A 反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B 混合气体的密度不随时间的变化而变化
C 单位时间内消耗3 mol H2,同时生成1 mol H2O
D CO2的体积分数在混合气体中保持不变
(3)一定温度下,第9 min时v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min时v正(CH3OH)。
【答案】0.125 D 小于
【解析】
根据坐标图中浓度与时间的关系计算反应速率;根据平衡状态的特征分析是否达到平衡状态;根据达到平衡状态时正逆速率的变化分析解答。
(1)从3 min到9 min,v(CO2)=![]() =
=![]() mol·L-1·min-1,则v(H2)=3v(CO2)=0.125 mol·L-1·min-1,故答案为:0.125;
mol·L-1·min-1,则v(H2)=3v(CO2)=0.125 mol·L-1·min-1,故答案为:0.125;
(2)反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)时反应速率仍然在发生变化,没有达到平衡状态,A项错误;密度是混合气体的质量和容器容积的比值,在反应过程中气体质量和容器容积始终保持不变,所以混合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态,B项错误;单位时间内消耗3 mol H2,同时一定生成1 mol H2O,不能说明反应达到平衡状态,C项错误;CO2的体积分数在混合气体中保持不变,说明反应达到平衡状态,D项正确,故答案为:D。
(3)第9 min时反应达到平衡状态,则第9 min时,v逆(CH3OH)= v正(CH3OH),而在平衡前正反应速率是减小的,所以第9 min时v逆(CH3OH)小于第3 min时v正(CH3OH),故答案为:小于。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】I.研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有______(填序号)。
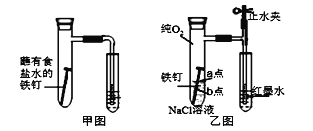
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐______(填“加快”、“不变”、“减慢”),你认为影响因素为_______。
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为_____ |
然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为 Fe -2e-=Fe2+ |
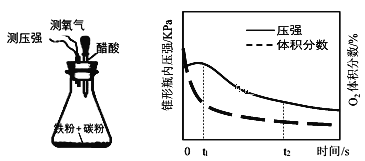
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_______腐蚀(填吸氧或析氢),原因_______。
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式______。
II.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为span>0.1000mol/L的KMnO4 标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在______(填“酸式”或“碱式”)滴定管中。
(2)到达滴定终点的标志是________。
(3)根据上述数据计算X=_______。
(4)误差分析(填偏高、偏低或无影响):若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物数量众多,分布极广,与人类关系非常密切。
(1)石油裂解得到某烃A,其球棍模型为![]() ,它是重要的化工基本原料。
,它是重要的化工基本原料。
①A的结构简式为_________,A的名称是____________。
②A与溴的四氯化碳溶液反应的化学方程式为_______________。

③A→C的反应类型是____,C+D→E的化学方程式为_______,鉴别C和D的方法是_______。
④A的同系物B的相对分子质量比A大14,B的结构有____种。
(2)生苹果肉遇碘酒变蓝,熟苹果汁能与银氨溶液反应,苹果由生到成熟时发生的相关反应方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃条件下将pH=12的氨水稀释过程中,下列说法正确的是___。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是____(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2molNH4Cl和0.1molNaOH全部溶于水,形成混合溶液(假设无损失)。
①___和___两种粒子的物质的量之和等于0.2mol。
②____和___两种粒子的物质的量之和比OH-多0.1mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定 CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将 CO2转化为 C 和 Li2CO3,充电时选用合适催化剂会释放出 CO2。下列说法正确的是
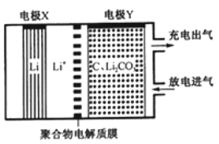
A.该电池放电时,Li+向电极 X 方向移动
B.该电池放电时,每转移 4 mol 电子,理论上生成 1mol C
C.该电池充电时,电极Y 与外接直流电源的负极相连
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e- = 3CO2↑+4Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物生产中有广泛用途,硼和铝位于同主族,具有相类似的化学性质。
(1)硼和氯气反应生成 BCl3,在该分子中,硼原子最外层有__________个电子。
(2)硼与氢氧化钠溶液反应生成 Na[B(OH)4](四羟基合硼酸钠)和氢气,该反应的化学方程式为____________。
(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离: NH3+H2O![]() +OH- ,硼酸在水中电离的方程式为____。
+OH- ,硼酸在水中电离的方程式为____。
(4)NaBH4 是有机合成中重要的还原剂。工业上合成方法之一是:Na2B4O7 +16Na+8H2 +7SiO2 ![]() 7Na2SiO3 +4NaBH4 ,在该反应中,氧化剂是___________,制备1 mol NaBH4时转移 ____________mol 电子。
7Na2SiO3 +4NaBH4 ,在该反应中,氧化剂是___________,制备1 mol NaBH4时转移 ____________mol 电子。
(5)NaBH4与水反应生成Na[B(OH)4]和一种气体,写出化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)燃煤发电是能量转换的过程,煤燃烧是由__________能转化为__________能,然后通过蒸汽,再转化为____________能,最后通过发动机,转化为____________能。
(2)火力发电的缺点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式是H2O![]() H++ OH-。下列叙述正确的是( )
H++ OH-。下列叙述正确的是( )
A.升高温度,KW增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com