
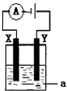
 Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是
Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是
| ||
| ||


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、对化工厂的废气、废水、废渣进行处理 |
| B、尽可能地节约使用不可再生资源,最大限度地减少废弃物 |
| C、在化工厂周围种草、种花、种树,使工厂成为花园式工厂 |
| D、绿色化学的核心就是用化学原理对环境污染进行有效治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
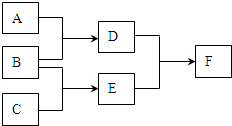 现有A、B、C、D、E、F六种物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如图:请回答:
现有A、B、C、D、E、F六种物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如图:请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
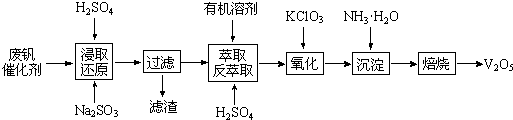
查看答案和解析>>
科目:高中化学 来源: 题型:
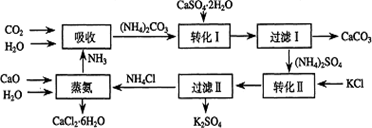
查看答案和解析>>
科目:高中化学 来源: 题型:
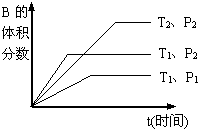
查看答案和解析>>
科目:高中化学 来源: 题型:
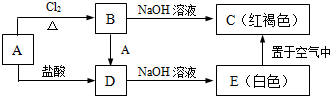
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com