
分析 (1)根据电解质的电离方程式计算微粒种类,溶液中的电解质电离:
NaCl═Na++Cl-;
NH3•H2O?NH4++OH-;
H2O?H++OH-;
(2)根据氮原子的物料守恒分析;
(3)根据电荷守恒和物料守恒综合分析,溶液中阴阳离子所带电荷相同,溶液中存在的离子为Na+、Cl-、NH4+、OH-、H+,即n(Na+)+n(NH4+)+n(H+)=n(Cl-)+n(OH-).
解答 解:(1)溶液中的电解质电离:
NaCl═Na++Cl-;
NH3•H2O?NH4++OH-;
H2O?H++OH-;
所以溶液中存在的微粒有:Na+、Cl-、NH3•H2O、NH4+、OH-、H2O、H+,所以共有7种微粒.
故答案为:7;
(2)无论NH4+水解程度和 NH3•H2O的电离的程度如何,但遵守物料守恒,即NH4+和 NH3•H2O的物质的量之和为0.01mol,
故答案为:NH4+和 NH3•H2O;
(3)溶液中阴阳离子所带电荷相同,溶液中存在的离子为Na+、Cl-、NH4+、OH-、H+,
即n(Na+)+n(NH4+)+n(H+)=n(Cl-)+n(OH-),n(Na+)=0.002mol,n(Cl-)=0.01mol,
所以0.002mol+n(NH4+)+n(H+)=0.01mol+n(OH-),n(NH4+)+n(H+)=0.008mol+n(OH-),
所以n(NH4+)+n(H+)-n(OH-)=0.008mol,NH4+,H+两种粒子数量之和比OH-多0.008mol,
故答案为:NH4+;H+.
点评 本题考查了弱电解质的电离平衡、盐类的水解、溶液中离子浓度大小的比较,比较难的是离子浓度大小的比较,可根据物料守恒、电荷守恒进行分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
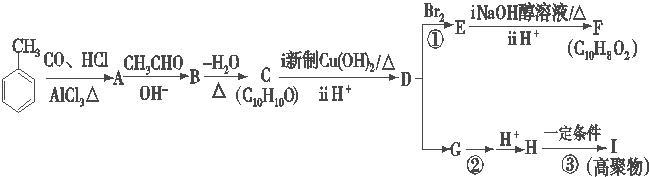
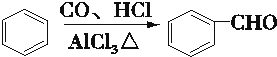
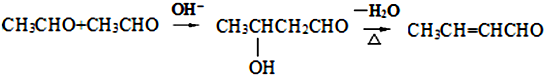
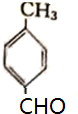 .
.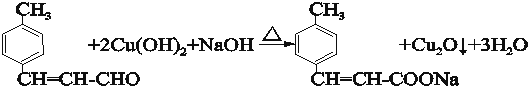 .
.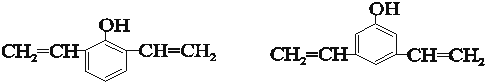 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
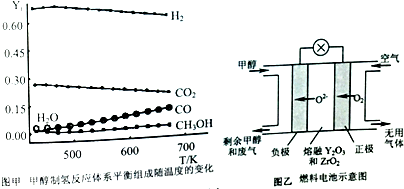
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池工作时,阳离子向负极移动 | |
| C. | 放电时Zn参与反应的电极为正极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
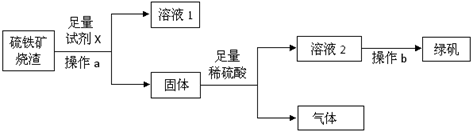
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
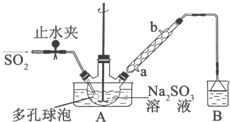 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用排饱和食盐水集气法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com