解:(1)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO
2进入B中,影响测定结果,
故答案为:防止空气中的水蒸气和CO
2进入B中,影响测定结果;
(2)测的反应后装置B增重1.35g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:

×100%=24%,
故答案为:24%;
(3)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸的作用是赶走溶液中溶解的过量的Cl
2,
故答案为:赶走溶液中溶解的过量的Cl
2;
(4)容量瓶是一种定容仪器,若是稀释到250mL,则采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、250mL容量瓶;
(5)a、滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b、锥形瓶不需要用待测液润洗,故b错误;
c、碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c正确;
d、滴定过程中,三价铁可以和碘离子发生反应生成亚铁离子和碘单质,碘单质遇到淀粉溶液显示蓝色,但是亚铁离子的绿色会产生干扰作用,故d正确;
故选cd;
(6)由于所取溶液(含Fe
3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe
3+)=c(KI)=0.5mol?L
-1,所以铁元素的百分含量为:
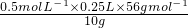
×100%=70%,
故答案为:70%;
(7)铁的质量分数是70%,氧元素的质量分数是24%,
所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
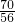
:
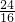
=5:6,
铁的氧化物的化学式为:Fe
5O
6,
故答案是:Fe
5O
6 .
分析:(1)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(2)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
(3)煮沸可以将水中的气体赶走;
(4)根据稀释液体和配制一定体积的溶液所选择的仪器来回答;
(5)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(6)根据元素守恒和化学反应方程式进行计算;
(7)根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
点评:本题考查了探究铁矿石中氧元素和铁元素的含量的方法,是一道探究物质的组成、测量物质的含量知识的一道综合考查题,考查学生分析和解决问题的能力,综合性强,难度中等.


 ×100%=24%,
×100%=24%,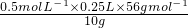 ×100%=70%,
×100%=70%,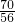 :
: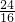 =5:6,
=5:6,

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案