
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
分析 A.元素分析仪特点是样品量小,速度快;
B.钠融法:将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素分别以氰化钠、氯化钠、溴化钠、硫化钠等的形式存在,再用无机定性分析法测定;
C.确定有机化合物的元素组成的方法:李比希法、钠融法、铜丝燃烧法、元素分析仪法;
D.分子中有几种氢原子,核磁共振氢谱有几个峰.
解答 解:A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量小,速度快,故A正确;
B.钠融法:将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素分别以氰化钠、氯化钠、溴化钠、硫化钠等的形式存在,再用无机定性分析法测定,钠融法不能定性确定有机物中是否含有C、H、O等元素,故B错误;
C.核磁共振和红外光谱法用于测定有机物中氢原子的种类和有机物中含有的化学键类型,故C错误;
D.甲醚为CH3-O-CH3,乙醇结构式为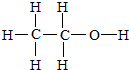 ,左边3个氢原子是一种,右边碳上氢原子一种,羟基上一中,有3种氢原子,特征峰是3个,故D错误.
,左边3个氢原子是一种,右边碳上氢原子一种,羟基上一中,有3种氢原子,特征峰是3个,故D错误.
故选A.
点评 本题考查化学研究基本方法及作用,掌握物质的研究方法是解题的关键,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 稳定性:HF>H2S | ||
| C. | 碱性:Ca(OH)2<Mg(OH)2 | D. | 非金属性:N<Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C26H54 | B. | C17H36 | C. | C80H162 | D. | C106H214 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应所需NaOH与氯气的物质的量之比一定为2:1 | |
| B. | 反应体系中n(NaCl):n(NaClO):n(NaC1O3)(物质的量之比)可能为11:1:2 | |
| C. | 若反应有amol氯气参加反应,则amol<转移电子数<$\frac{5a}{3}$mol | |
| D. | 反应中NaC1O和NaClO3为氧化产物,且物质的量之比一定为l:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
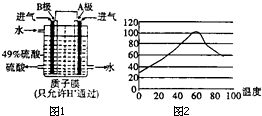 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com