
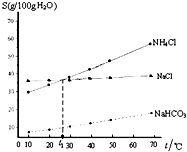
| A. | t1℃时,饱和NaCl和NH4Cl 溶液的物质的量浓度相同 | |
| B. | 相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多 | |
| C. | NH4Cl 溶解度随温度变化较大 | |
| D. | 工业上制纯碱可以向饱和的NaCl溶液中通入NH3和CO2,会有NaHCO3固体析出 |
分析 A.依据题干溶解度曲线分析判断,氯化铵和氯化钠在t1℃时,溶解度相同,质量分数相同,但溶质摩尔质量不同,物质的量浓度不同;
B.依据题干溶解度曲线分析判断NaHCO3与NaCl、NH4Cl的溶解度大小;
C.根据图象中氯化铵的溶解度与温度的关系判断;
D、图象分析得到:NaHCO3 在水中的溶解度不大且比NaCl 和NH4Cl的溶解度小很多.
解答 解:A.t1℃时,氯化钠和氯化铵的溶解度相同,所以饱和溶液中溶质质量分数相同,饱和NaCl 和NH4Cl 溶液的质量分数相同,但溶质摩尔质量不同,溶质物质的量不同,所以饱和NaCl和NH4Cl 溶液的物质的量浓度不相同,故A错误;
B.根据图象曲线变化可知,相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多,故B正确;
C.根据图象可知,氯化铵的溶解度随着温度的增大而增大,且受温度影响较大,故C正确;
D、结合图象中的溶解度曲线饱和可知,在水中的溶解度不大且碳酸氢钠溶解度比NaCl和NH4Cl的溶解度小很多,向饱和的NaCl 溶液中通入NH3和CO2,有NaHCO3 固体析出,故D正确;
故选A.
点评 本题考查了溶解度与温度变化的关系及其应用,题目难度中等,侧重考查学生从溶解度曲线图上读取信息、分析及获取信息的能力,明确溶解度概念和饱和溶液的组成特征为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Ba(OH)2溶液若有沉淀说明有CO32- | |
| B. | 加入盐酸若有能使澄清石灰水变浑浊的气体生成,说明含CO32- | |
| C. | 先加入BaCl2溶液,过滤.再在沉淀中加入盐酸,看能否产生使澄清石灰水变浑浊的无色无味气体 | |
| D. | 先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 | B. | KNO3 | C. | FeSO4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构中有三个双键,可与溴水发生加成反应 | |
| C. | 苯的邻位二元取代产物只有一种 | |
| D. | 甲苯不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.| 化学键 | H-H | O=O | O-H |
| 键能(kJ•mol-1) | X | 496.4 | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com