
 Fe3O4+4H2(2分)
Fe3O4+4H2(2分) Fe3O4+4H2
Fe3O4+4H2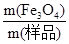 =
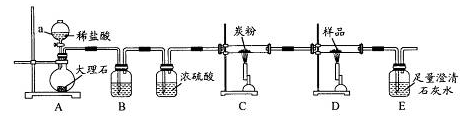
=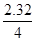 ×100%=58%,同时可以计算这个过程中生成n(CO2)=0.06mol。而根据m(CaCO3)可以计算n(CO2)=0.06mol,说明经过碳粉后还剩余0.02mol CO2。由于碳粉与CO2高温反应产生CO,CO高温还原Fe3O4后可能还有CO剩余,所以缺一尾气处理装置。因为CO不能直接排入大气。
×100%=58%,同时可以计算这个过程中生成n(CO2)=0.06mol。而根据m(CaCO3)可以计算n(CO2)=0.06mol,说明经过碳粉后还剩余0.02mol CO2。由于碳粉与CO2高温反应产生CO,CO高温还原Fe3O4后可能还有CO剩余,所以缺一尾气处理装置。因为CO不能直接排入大气。

 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:不详 题型:实验题
 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①② | B.②⑨ | C.⑨④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属与盐溶液间的反应一定是置换反应 |
| B.能与酸反应的氧化物一定是碱性氧化物 |
| C.1 1H2和2 1H2的物理性质略有差异,化学性质几乎完全相同 |
| D.常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO a > b | B.乙醇溶液 a =b |
| C.NaHSO4 a > b | D.石灰水 a < b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
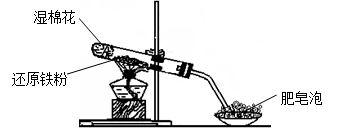
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸铜 | B.硝酸铜 | C.硫酸铜 | D.氢氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com