
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
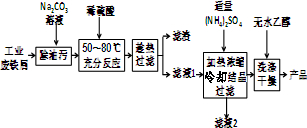
分析 Ⅰ.(1)Na2CO3水解溶液呈碱性,碱性溶液能用于除油污;
(2)根据表中的溶解度数据可知,相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O,据此答题;
(3)硫酸亚铁铵在加热过程中晶体失去结晶水及被氧化且容易被氧化;
Ⅱ.(4)根据47.040g纯净的硫酸亚铁铵和剩余固体34.080g的质量比可知水的质量,进而计算出水的物质的量;
(5)酸性高锰酸钾标准溶液有强氧化性,亚铁离子与高锰酸钾发生氧化还原反应生成铁离子和锰离子,在滴定终点时锥形瓶内溶液变为紫红色,据此答题;
(6)根据步骤1可知水的物质的量,根据步骤2中关系式5Fe2+~MnO4-,可计算出亚铁离子的物质的量,根据步骤3中BaSO4沉淀质量为5.592g,可知硫酸根离子的物质的量.
解答 解:Ⅰ.(1)Na2CO3水解溶液呈碱性,碱性溶液能用于除油污,反应的离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)根据表中的溶解度数据可知,相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O,所以加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体,
故答案为:相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O;
(3)硫酸亚铁铵在加热过程中晶体失去结晶水及被氧化且容易被氧化,所以用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干,
故答案为:防止在加热过程中晶体失去结晶水及被氧化;
Ⅱ.(4)根据47.040g纯净的硫酸亚铁铵和剩余固体34.080g的质量比可知水的质量为47.040g-34.080g=12.96g,所以水的物质的量为0.72mol,
故答案为:0.72mol;
(5)酸性高锰酸钾标准溶液有强氧化性,所以要用酸式滴定管,亚铁离子与高锰酸钾发生氧化还原反应生成铁离子和锰离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,
故答案为:酸;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色;
(6)根据步骤1可知水的物质的量为0.72mol,根据步骤2中关系式5Fe2+~MnO4-,可计算出亚铁离子的物质的量为5×0.1000mol/L×0.024L×$\frac{250}{25}$=0.12mol,根据步骤3中BaSO4沉淀质量为5.592g即为$\frac{5.592}{233}$mol=0.024mol,可知硫酸根离子的物质的量为为0.024mol×$\frac{250}{25}$=0.24mol,所以x:y:z=0.12mol:(0.024mol-0.12mol):0.72mol=1:1:6,
故答案为:1:1:6.
点评 本题考查化学工艺流程、盐类水解、化学实验等,难度中等,需要学生具有扎实的基础与运用知识分析解决问题的能力,注意基础知识的理解掌握.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 | |
| B. | 乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 | |
| C. | 甲硫醇、乙硫醇与丁硫醇互为同系物 | |
| D. | 沸点不同的丁硫醇有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
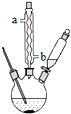 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
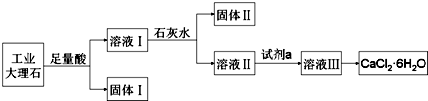
| A. | 固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O产品的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | (C6H10O5)n 可表示淀粉或纤维素 | |
| B. | 反应②化学方程式为 C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑ | |
| C. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| D. | 反应③和④都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑨ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
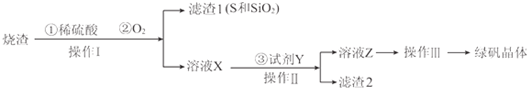
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com