
| A. | 其密度之比等于对应的物质的量之比 | |
| B. | 其质量之比等于相对分子质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量的倒数之比 | |
| D. | 等体积的三种气体,其物质的量比等于相对分子质量之比 |
分析 A.相同条件下,气体密度ρ=$\frac{M}{{V}_{m}}$;
B.根据m=nM知,不同气体其质量与物质的量、摩尔质量有关;
C.相同条件下气体摩尔体积相等,等质量的三种气体,其体积V=$\frac{m}{M}{V}_{m}$;
D.相同体积下气体摩尔体积相等,根据n=$\frac{V}{{V}_{m}}$判断.
解答 解:A.相同条件下,气体摩尔体积相等,根据ρ=$\frac{M}{{V}_{m}}$知,气体密度与摩尔质量成正比,所以其密度之比等于摩尔质量之比,与物质的量无关,故A错误;
B.根据m=nM知,不同气体其质量与物质的量、摩尔质量有关,相同物质的量时,其质量之比等于相对分子质量之比,故B错误;
C.相同条件下气体摩尔体积相等,等质量的三种气体,根据V=$\frac{m}{M}{V}_{m}$知,等质量的三种气体,其体积之比等于摩尔质量反比,即等于相对分子质量反比,故C正确;
D.相同体积下气体摩尔体积相等,根据n=$\frac{V}{{V}_{m}}$知,等体积时其物质的量相等,与相对分子质量无关,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律,为高频考点,明确各个物理量之间关系是解本题关键,注意气体摩尔体积适用范围及其适用条件,知道气体摩尔质量与相对分子质量关系,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为60% | |
| B. | 在25℃时,反应可表示为X+3Y═2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 升高温度此反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
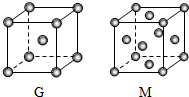 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经测定某物质只含一种元素,则该物质一定是单质 | |
| B. | 阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物 | |
| C. | 既能和酸反应又能和碱反应的化合物一定为两性化合物 | |
| D. | 酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸,消石灰,小苏打 | B. | 碳酸,乙醇,苛性钠 | ||
| C. | 硫酸,烧碱,水 | D. | 硫酸,纯碱,石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com