
A����֪298Kʱ��2SO2(g)��O2(g)  2SO3(g) ��H=��197kJ/ mol���Ը��Ȼ�ѧ����ʽ����Ϊ���ڸ������£����ܱ�������ͨ��2ĦSO2��1ĦO2���ﵽƽ��ʱ�ų�������197 kJ 2SO3(g) ��H=��197kJ/ mol���Ը��Ȼ�ѧ����ʽ����Ϊ���ڸ������£����ܱ�������ͨ��2ĦSO2��1ĦO2���ﵽƽ��ʱ�ų�������197 kJ |
| B��CO(g)��ȼ������283.0kJ/mol����2CO2(g)===2CO(g)��O2(g)��Ӧ�ġ�H��+��2��283.0��kJ/mol |
| C�����ȷ�Ӧ��ָ��Ӧ�������е����������������������е��������������ǿ���Ӧ�����Ƿ���Ҫ���� |
| D�������з�Ӧ��HCl(aq) + NaOH(aq)="NaCl(aq)" + H2O(l)��H=��Q1kJ/mol |
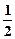 H2SO4(Ũ)+NaOH(aq)=
H2SO4(Ũ)+NaOH(aq)= 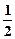 Na2SO4(aq)+H2O(l) ��H=��Q2kJ/mol
Na2SO4(aq)+H2O(l) ��H=��Q2kJ/mol
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100KJ | B��60KJ | C��50KJ | D��30KJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ��Ӧ���������������⣬�������������ı仯 |
| B�����ȷ�Ӧ����Ҫ���ȼ��ɷ��� |
| C����Ҫ���������Ļ�ѧ��Ӧ�������ȷ�Ӧ |
| D����ѧ�������ͷ���������ѧ���γ���Ҫ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ѧ�仯�а��������仯����Ҫԭ�����л�ѧ���Ķ��Ѻ��γ� |
| B�����ij��Ӧ�Ƿ��ȷ�Ӧ����ô�÷�Ӧ������Ⱦ�һ���ܷ�Ӧ |
| C����ͭ��п��ϡ���ṹ�ɵ�ԭ����У�п�Ǹ��� |
| D���ֻ�����ڳ��ʱ���ǵ���ת��Ϊ��ѧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3�������仯����ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
2NH3�������仯����ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��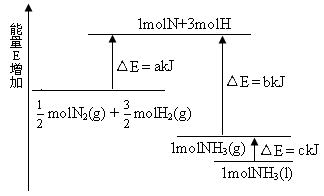
A��N2(g)+3H2(g)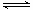 2NH3(1) ��H��2(a-b-c)kJ��mol-1 2NH3(1) ��H��2(a-b-c)kJ��mol-1 |
B��N2(g)+3H2(g)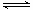 2NH3(g) ��H��2(b-a)kJ��mol-1 2NH3(g) ��H��2(b-a)kJ��mol-1 |
C��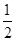 N2(g)+ N2(g)+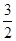 H2(g) H2(g) 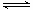 NH3(1) ��H��(b+c-a)kJ��mol-1 NH3(1) ��H��(b+c-a)kJ��mol-1 |
D��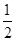 N2(g)+ N2(g)+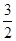 H2(g) H2(g)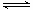 NH3(g) ��H��(a+b)kJ��mol-1 NH3(g) ��H��(a+b)kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ȷ�Ӧ������Ⱦ��ܷ��� |
| B��1mol��ȼ��ȼ������������ų����������Ǹ����ʵ�ȼ���� |
| C����Ӧ�������������������������ķ�Ӧ�Ƿ��ȷ�Ӧ |
| D��ǿ�������Һ�ĵ������������������Һ�ĵ�������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g)
2SO3(g)  H = ��190 kJ��mol��1
H = ��190 kJ��mol��1 O2 (g) = CO2 (g)
O2 (g) = CO2 (g)  H = ��283.0 kJ��mol��1
H = ��283.0 kJ��mol��1 H = ��296.0 kJ��mol��1
H = ��296.0 kJ��mol��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ʯī�������Ƚ��ʯ�� | B��ʯī�ͽ��ʯ����̼��ͬλ�� |
| C�����ʯת��Ϊʯī�������仯 | D�����ʯ��ʯī���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CO2��g��
2CO2��g�� ������=v���棩ʱ��������Ũ�ȴ������к㶨��ϵ��
������=v���棩ʱ��������Ũ�ȴ������к㶨��ϵ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com