

分析 (1)净化除去悬浮杂质,软化除去水中钙、镁离子;
(2)先沉淀、再过滤,最后消毒处理;
(3)对自来水进行杀菌消毒,且不会造成二次污染,只有臭氧的还原产物对水无污染;
(4)①将待处理水的pH调到9左右,再加入绿矾,可得到铁离子,水解生成胶体;
②发生氧化还原反应生成Na2FeO4;
(5)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),以此来解答.
解答 解:(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是除去水中较多的钙离子和镁离子,
故答案为:除去水中较多的钙离子和镁离子;
(2)生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,故答案为:混凝沉淀→过滤→杀菌消毒;
(3)福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,故答案为:d;
(4)①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体),
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-═4Fe(OH)3(胶体);
②由Fe(0H)3制取Na2FeO4的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,
故答案为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;
(5)Na2CO3溶液的浓度为5.6×10-5mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×5.6×10-5mol/L=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{2.8×1{0}^{-5}}$mol/L=1×10-4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10-4mol/L=2×10-4mol/L,故答案为:2×10-4mol/L.
点评 本题考查较综合,涉及混合物分离提纯、溶度积的计算、氧化还原反应及应用等,注重高频考点的考查,综合性较强,题目难度较大,注意化学与生活的联系.


科目:高中化学 来源: 题型:填空题
 .
.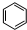 +HNO3$→_{50-60℃}^{浓硫酸}$
+HNO3$→_{50-60℃}^{浓硫酸}$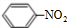 +H2O,反应类型取代反应.
+H2O,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
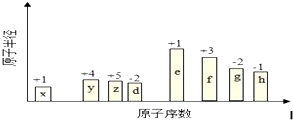
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;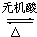 CH3COOH+(CH3)2CHOH.
CH3COOH+(CH3)2CHOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都属于高分子化合物 | |
| B. | 淀粉、油脂和蛋白质都能发生水解反应 | |
| C. | 油脂有油和脂肪之分,但都属于酯 | |
| D. | 蛋白质既能与酸反应又能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Cu片作阳极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+H2↑+2OH- | |
| B. | 用两个铜片作电极电解AgNO3溶液:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$Ag+O2+4H+ | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.如图是钒电池基本工作原理示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com