
| A、用药匙取用粉末状或小颗粒状固体 | ||
| B、称量固体NaOH的质量时,分别在两个托盘上垫上质量相同的滤纸 | ||
C、给盛有约
| ||
| D、加热蒸发皿时无需垫石棉网 |


科目:高中化学 来源: 题型:
| A、“落汤螃蟹着红袍”肯定发生了化学变化 |
| B、“滴水石穿、绳锯木断”一定不包含化学变化 |
| C、“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 |
| D、“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个 | B、2个 | C、3个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L Cl2与过量NaOH溶液反应,转移的电子总数为0.2NA |
| B、0.1mol Na2O2中阴阳离子的数目均为0.2 NA |
| C、分子数为NA 的CO、C2H4混合气体的质量为28g,体积约为22.4L |
| D、盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO,K=4.5×10-4,次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
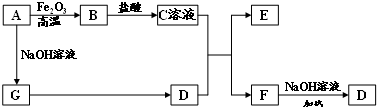
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com