
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为__________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率________________(填“提高”“不变”或“降低”)。
②着吸收反应的进行,吸收剂溶液的pH逐渐____________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______________反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是____________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________。
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______。
【答案】亚氯酸钠 ![]() 提高 减小 大于 NO溶解度较低或脱硝反应活化能较高 形成
提高 减小 大于 NO溶解度较低或脱硝反应活化能较高 形成![]() 沉淀,反应平衡向产物方向移动,
沉淀,反应平衡向产物方向移动,![]() 转化率提高
转化率提高 ![]()
【解析】
(1)![]() 的化学名称为亚氯酸钠。
的化学名称为亚氯酸钠。
(2)①![]() 具有氧化性,且溶液初始状态为碱性,在脱硝过程中主要反应的离子方程式为
具有氧化性,且溶液初始状态为碱性,在脱硝过程中主要反应的离子方程式为![]() ;增加压强,平衡向气体体积减小的方向移动,即正向移动,
;增加压强,平衡向气体体积减小的方向移动,即正向移动,![]() 的转化率提高。
的转化率提高。
②根据吸收反应![]() 、
、![]() 可知,随着反应进行,吸收剂溶液pH逐渐减小。
可知,随着反应进行,吸收剂溶液pH逐渐减小。
③根据表中数据可知,相同时间内,![]() ,则脱硫反应速率大于脱硝反应速率;主要原因除了
,则脱硫反应速率大于脱硝反应速率;主要原因除了![]() 和
和![]() 在烟气中的初始浓度不同外,还可能是
在烟气中的初始浓度不同外,还可能是![]() 溶解度较低或脱硝反应活化能较高。
溶解度较低或脱硝反应活化能较高。
(3)①![]() 脱硫生成的
脱硫生成的![]() 沉淀,在一定程度上降低了
沉淀,在一定程度上降低了![]() 的浓度,使反应平衡向产物方向移动,
的浓度,使反应平衡向产物方向移动,![]() 转化率提高。
转化率提高。
②根据盖斯定律可知,该反应可由![]() 得到,则
得到,则![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用原电池原理可以除去酸性废水中的三氯乙烯和![]() ,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
,其原理如图所示(导电壳内部为纳米铁)。下列说法正确的是
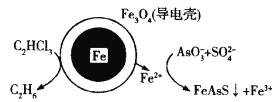
A.纳米铁发生还原反应
B.正极电极反应式:C2HCl3+5H++8e-=C2H6+3Cl-
C.导电壳上电极反应式:![]() +
+![]() +14Fe2++14H+=FeAsS↓+13Fe3++7H2O
+14Fe2++14H+=FeAsS↓+13Fe3++7H2O
D.当电路中有0.4 mol电子转移时,就会有11.2 L乙烷生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶态分散系是一种粒子直径介于1~100nm的一种分散系,如图是Fe(OH)3胶体的结构示意图,下列说法不正确的是( )
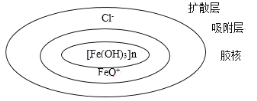
A.据图可以判断,发生了Fe(OH)3(胶体)+HCl![]() FeOCl+2H2O的反应
FeOCl+2H2O的反应
B.当用其做电泳实验时,阴极管的液面低于阳极管
C.电泳实验出现的现象的原因是:扩散层与吸附层分离,带正电的胶核向阴极移动
D.若对其加热一段时间,会发生胶体的聚沉作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
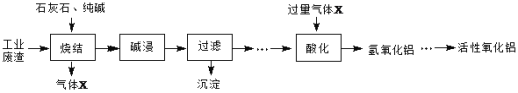
(1)烧结产物主要有NaAlO2、CaSiO3、NaFeO2及气体X。气体X是_________。
(2)烧结产物NaAlO2也可以通过所学知识由Al2O3转化得到,写出反应的离子方程式____
(3)写出由氢氧化铝制备氧化铝的化学方程式:____________________。
(4)碱浸前需将烧结产物进行粉碎,其目的是_________。碱浸过程中,NaFeO2可与水应生成NaOH和一种含铁的化合物,写出该反应的化学方程式_________________。
(5)某同学设计了由废渣(Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤。请利用所学和流程中的信息补充完整:向一定量滤渣中加入足量的稀硫酸,充分反应,无不溶物后,滴加NaOH溶液至生成的沉淀不再减少,过滤,__________,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶。(实验中必须使用的试剂:CO2气体、稀硫酸、蒸馏水)
(6)已知试剂EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应。现测定硫酸铝晶体样品中Al2(SO4)3·18H2O(摩尔质量为666g/mol)质量分数的实验步骤如下:(杂质不与EDTA反应)
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却。
步骤3:再向上述溶液中加入c2 mol·L- 1Pb(NO3)2 溶液V2mL 恰好与过量的EDTA溶液完全反应。
请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。__________(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500 ℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25 ℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是( )
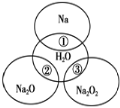
A.反应③最多能产生0.05molO2
B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑
C.①、②、③都属于氧化还原反应
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中为实验室制取氯气及性质验证的装置图:
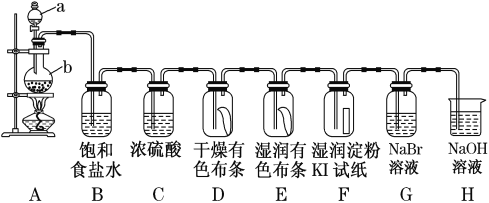
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________
(2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。
(3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________

(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com