
| A. | AlO2-、SO42-、Cl-、K+ | B. | Al3+、Ca2+、HCO3-、Na+ | ||
| C. | Fe3+、NH4+、SO42-、SCN- | D. | H+、Cl-、Na+、HS- |
分析 A、离子间没有发生反应,离子浓度不变;
B、Al3+和HCO3-发生双水解生成氢氧化铝和二氧化碳气体;
C、含有大量Fe3+的溶液中SCN-不能存在;
D、H+和HS-生成硫化氢气体.
解答 解:A、离子间没有发生反应,离子浓度不变,所以AlO2-、SO42-、Cl-、K+可以大量共存,故A正确;
B、Al3+和HCO3-发生双水解生成氢氧化铝和二氧化碳气体,不能大量共存,故B错误;
C、Fe3+和SCN-结合成络合物,而不能存在,故C错误;
D、H+和HS-生成硫化氢气体,而不能存在,故D错误;
故选A.
点评 本题考查离子共存,题目难度中等,注意离子的性质,注意分析题中隐含条件,为该类题目常考查方式.


科目:高中化学 来源: 题型:选择题
| A. | 砷(As)位于周期表第4周期第ⅤA族 | B. | 气态氢化物稳定性:AsH3>PH3>NH3 | ||
| C. | 含氧酸酸性:H3AsO4>HNO3>H3PO4 | D. | 氢化物沸点:AsH3>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用溴水或酸性高锰酸钾溶液可以鉴别1-己烯和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 燃烧热/kJ•mol-1 | |
| 铝 | 660 | 2467 | 602 |
| 氧化铝 | 2050 | 2980 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
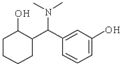 )是一种镇痛和麻醉药物,可由化合物B(
)是一种镇痛和麻醉药物,可由化合物B( )通过以下路线合成得到.
)通过以下路线合成得到.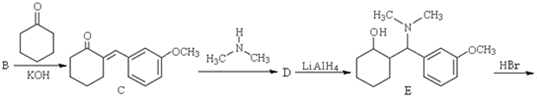
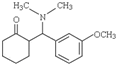 .
.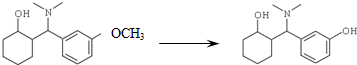 +HBr+CH3Br.
+HBr+CH3Br. 等.
等.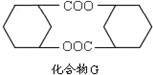 所示)的合成路线流程图(无机试剂任选).
所示)的合成路线流程图(无机试剂任选).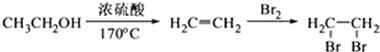
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com