
| A. | 乙醇和乙烯 | B. | 甲醛和葡萄糖 | C. | 乙烯和乙酸乙酯 | D. | 丙烷和乙醛 |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成H2O的质量也一定,则说明混合物各组分分子中含氢量相等,据此对各选项进行判断.
解答 解:A.乙醇分子式为C2H6O,氢元素的质量分数为$\frac{6}{46}$=$\frac{3}{23}$,乙烯分子中含氢量为:$\frac{4}{28}$=$\frac{1}{7}$,二者的含氢量不同,不符合题意,故A错误;
B.甲醛的分子式为CH2O,葡萄糖的分子式为C6H12O6,其最简式为CH2O,所以二者的含氢量相同,符合题意,故B正确;
C.乙烯分子中含氢量为:$\frac{4}{28}$=$\frac{1}{7}$,乙酸乙酯的分子式为:C4H8O2,最简式为C2H4O,其含氢量为:$\frac{4}{44}$=$\frac{1}{11}$,二者的含氢量不同,故C错误;
D.丙烷分子式为C3H8、乙醛分子式为C2H4O,二者的相对分子质量都是44,而含有的H原子数不同,则含氢量不同,不符合条件,故D错误;
故选B.
点评 本题考查混合物的计算,难度中等,根据题干信息得出混合物分子中含氢量相等是解题的关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 目的 | |
| A | 食醋浸泡水垢 | 比较乙酸和碳酸的酸性强弱 |
| B | 向蔗糖溶液中加入稀硫酸,水浴加热,5min后向其中加入新制Cu(OH)2的悬浊液,加热. | 证明蔗糖水解产物中有葡萄糖 |
| C | 向NaBr溶液中加入少量氯水,振荡后加入少量四氯化碳,振荡,静置. | 比较氯、溴非金属性强弱 |
| D | 钠分别与水和乙醇反应 | 乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
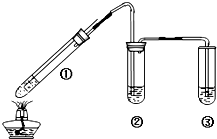 某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | B. | 空气:C2H2、CO2、SO2、苯酚 | ||
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | D. | 高锰酸钾溶液:H+、Na+、SO42-、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
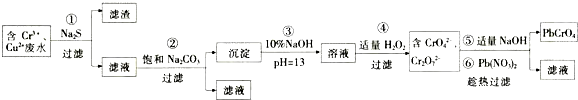
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形
(1)NF3分子中N原子的杂化轨道类型为sp3,该分子的空间构型为三角锥形查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com