
| A. | Na+ | B. | Al3+ | C. | K+ | D. | S2- |
科目:高中化学 来源: 题型:选择题
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 第一电离能呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
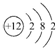 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该元素位于第3周期第ⅡA族 | B. | 该元素位于第2周期第Ⅷ族 | ||
| C. | 该元素位于第2周期第ⅡA族 | D. | 该元素位于第4周期第ⅡB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | B. | 它不可能与NaOH溶液反应 | ||
| C. | 它既含离子键又含共价键 | D. | 它受热时不会分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题
短周期元素Q、R、T、W在元素周期表中的位置如图:其中T所处的周期序数与主族序数相等,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 多电子原子中,在离核较近的区域内运动的电子能量较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ②CH3CH2CH(CH3)CH3 ③CH4 ④
②CH3CH2CH(CH3)CH3 ③CH4 ④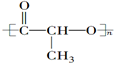 ⑤
⑤ ⑥
⑥ ⑦
⑦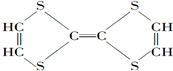

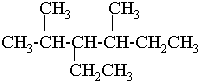
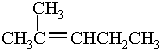 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和食盐水法收集Cl2 | |
| B. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| C. | 加入催化剂可以提高原料转化率,生成更多产物 | |
| D. | 分别用等体积的蒸馏水和0.01mol/L的硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com