
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、液溴的保存用带橡胶塞的棕色试剂瓶 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |


科目:高中化学 来源: 题型:
| A、0.5×(10-8+10-10)mol/L |
| B、(10-8+10-10)mol/L |
| C、(1×10-14-5×10-5)mol/L |
| D、1×10-11 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
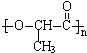 ,则形成该高聚物的单体结构简式为
,则形成该高聚物的单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 金属 | a | b | c |
| 与冷水反应 | 不反应 | 缓慢反应 | 未实验 |
| 与2mol?1-1的HCl溶液反应 | 溶解并放出气体 | 未实验 | 不反应 |
| A、a>b>c |
| B、b>a>c |
| C、a>c>b |
| D、c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 七氧化二锰 Mn2O7 |
| B、酸性氧化物 干冰 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com