
常温下,pH=3的HA溶液V1 mL与pH=11的KOH溶液V2 mL混合,则下列说法正确的是( )
A.若V1=V2,则反应后溶液的pH一定等于7
B.若反应后溶液呈酸性,则V1一定小于V2
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈中性,则混合液中一定存在c(H+)+c(OH-)=2×10-7 mol·L-1
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)
从废料中回收氧化钴(CoO)的工艺流程如下:
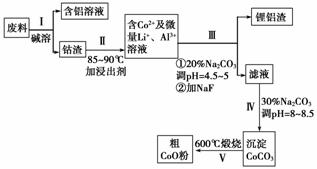
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为____________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的化学反应方程式为(产物中只有一种酸根)________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:________________________________________________________________________
________________________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:________________________________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是________________________________________________________________________。
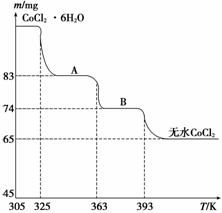
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质分别是
①____________、②____________、③____________、
④____________、⑤____________。
(2)写出①处发生反应的离子方程式_________________________________________
________________________________________________________________________;
写出③处发生反应的化学方程式_______________________________ ___________。
___________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________________________________________________________________;
氧化铜________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知AgI为黄色沉淀,AgCl为白色沉淀,25 ℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl饱和溶液中c(Ag+)=1.30×10-5 mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是( )
A.溶液中所含溶质的离子浓度大小关系为c(NO )>c(K+)>c(Cl-)>c(I-)>c(Ag+)
)>c(K+)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加KCl溶液、黄色沉淀可能转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,某浓度的盐酸、氯化铵溶液中由水电离出的氢离子浓度分别为1.0×10-a mol·L-1、1.0×10-b mol·L-1,这两种溶液的pH之和为( )
A.14-a+b B.14+a+b
C.14-a-b D.14+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.淀粉和蛋白质均可作为生产葡萄糖的原料
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.含有0.1 mol·L-1Ca2+溶液在中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
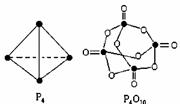
白磷与氧可发生如下反应:P4+5O2=== P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是
H,其中正确的是
A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com