
 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 、
、 ,
, 或
或  ;
;

科目:高中化学 来源: 题型:
| 判断依据 | 结论(写结构简式) |
| 核磁共振氢谱有 个峰 | |
| 核磁共振氢谱有 个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
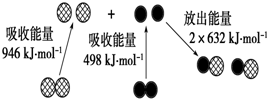 (1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、1:3 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a和d是同分异构体,且都可以发生取代反应 |
| B、b和c是同系物,且都只有一种一氯代物 |
| C、a和d都能发生加成反应,且在空气中燃烧都有黑烟 |
| D、c和d是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12种 | B、13种 |
| C、16种 | D、18种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com