
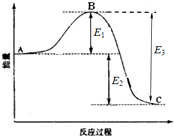
 已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:
已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:分析 (1)根据A、C分别表示反应物总能量的生成物总能量;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)根据64g SO2气体氧化为SO3气体时放出99kJ的热量来求.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,故答案为:反应物总能量;生成物总能量;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-E2kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-2E2kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-2E2kJ•mol-1,故答案为:-2E2;
(3)因64g 即1molSO2气体氧化为SO3气体时放出99kJ的热量,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
所以SO2氧化为SO3的热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1.
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可用于萃取碘水中的碘 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 蒸馏装置中,温度计的水银球应插入到混合溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com