
分析 金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀两种,中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;酸性环境下,钢铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀两种,正极上都是氧气得电子发生还原反应,负极上是金属失电子发生氧化反应,钢铁发生吸氧腐蚀时,铁作负极,发生失电子的氧化反应,即Fe=Fe2++2e-.
故答案为:吸氧腐蚀;析氢腐蚀;还原;Fe=Fe2++2e-.
点评 本题考查了金属的电化学腐蚀及电解池原理,明确钢铁所处环境的酸碱性即可确定其电化学腐蚀类型,题目难度不大,注意把握电极方程式的书写方法.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
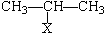 Ⅰ
Ⅰ CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.
CH=CH2)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点. 或
或
 CHBrCH3.
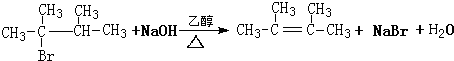
CHBrCH3. CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.
CHBrCH3与足量氢氧化钠溶液共热得到A,得到A时,苯环上没有化学键的断裂和生成.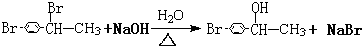 .
.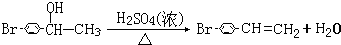 .
.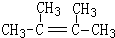 ,1molB完全燃烧时耗氧9mol
,1molB完全燃烧时耗氧9mol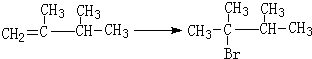
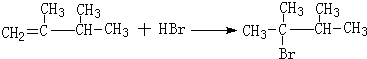
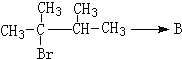
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是氧化剂 | B. | NH3被氧化 | ||
| C. | NO只是还原剂 | D. | 生成60gNO转移的5mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
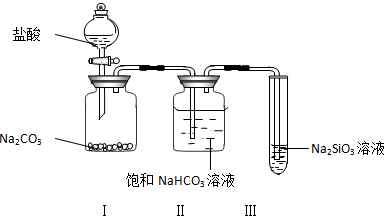
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
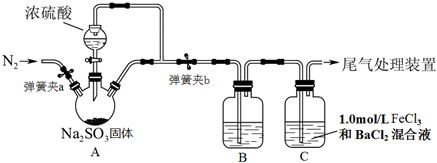
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下0.1 mol•L-1的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,c(NH4+) 由大到小的顺序为②>①>③ | |
| B. | 常温下0.4 mol•L-1CH3COOH溶液和0.2 mol•L-1 NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.2 mol•L-1 NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1 mol•L-1的氨水与0.05 mol•L-1 H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中通入一定量的SO2气体可增强氯水的漂白性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、酸性高锰酸钾溶液褪色 | |
| C. | 已知酸性:H2SO4>HClO,则SO2通入漂白粉溶液中可生成次氯酸 | |
| D. | 紫色石蕊试液中通入SO2,溶液变红后不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入NaHCO3溶液会抑制水的电离 | |
| B. | 35℃时纯水中c(H+)>c(OH-) | |
| C. | 向水中加入NaHSO4溶液会抑制水的电离 | |
| D. | c(H+)随着温度的升高而降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com