
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )
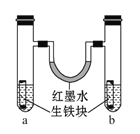
A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
科目:高中化学 来源: 题型:
【题目】如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
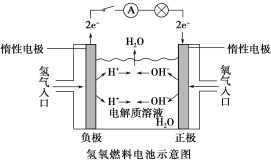
(1)酸式电池的电极反应:负极______________,正极________________;电池总反应:___________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:负极______________,正极_____________;电池总反应:________________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用毛笔书写后的纸张作为空气电极,设计并组装了轻型、柔性且可折叠的可充电锂空气电池(图1),电池的工作原理如图2。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 放电时,Li+由正极经过有机电解质溶液移向负极
C. 开关K闭合给锂电池充电,金属锂电极增重14g,空气电极放出22.4L的O2
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2↑+2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.丙烯和乙烯都是石油化工最重要的基础原料。主要工业生产途径如下:
途径①CH3CH2CH3(g)![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径②nCH3OH(g)![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9kJ/mol、2056.5 kJ/mol和285.8 kJ/mol,则△H1=_____ kJ/mol。
(2)途径①制备丙烯,要提高丙烯的产率最好采用______条件。(填“高压”或“低压”)
(3)途径②控制适当的条件(温度、压强、催化剂等)可以调节N[N=n(乙烯)/n(丙烯)]在0~1.5之间变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是__________。
②在体积为V的反应器中加入一定量的甲醇,反应1h后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
II:(4)含硫煤燃烧产生SO2,利用尿素[CO(NH2)2]水解的溶液可以吸收空气中的SO2。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)
①氨基甲酸铵会与空气中的SO2和O2反应生成(NH4)2SO4,该反应的化学方程式为________。
②-定条件下,用尿素水解液吸收空气中的SO2,测得SO2的吸收率随溶液的温度变化如图甲所示。温度高于60℃时,SO2的吸收率逐渐升高的原因是________。
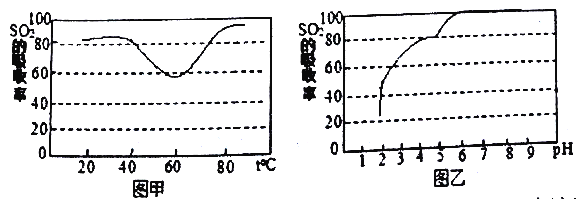
③尿素溶液吸收SO2的吸收率随溶液的pH变化如图乙所示。尿素深液吸收空气中的SO2后,溶液的pH会降低,为提高SO2的吸收率和充分回收产物,最好向溶液中加入______(填溶液的名称)并控制pH为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X均为短周期元素形成的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:
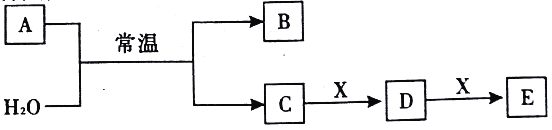
(1)若A为单质,且C为一元强酸。
①化合物B 的结构式为_________。
②写出一种工业制备单质A的离子方程式:__________。
③X可能为_______(填字母代号)。
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成的G的浓溶液遇C有白烟产生。
①A的电子式为_________。
②A与H2O反应的化学方程式为_________。
③室温下,NH2OH(羟氨)会发生分解生成C、D,试写出其分解反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
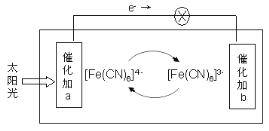
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4- - e- = [Fe(CN)6]3-
C.[Fe(CN)6]3-在催化剂b表面被氧化
D.电解质溶液中的[Fe(CN6)]4-和[Fe(CN6)]3-浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
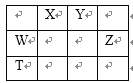
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系:
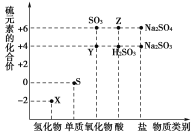
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为________。
(3)检验物质Y的方法是_________________________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为______________________________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com