
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
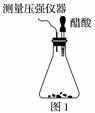
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是________________________________________________________________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
答案 (1)②2.0 ③碳粉含量的影响
(2)吸氧  还原 2H2O+O2+4e-===4OH-(或4H++O2+4e-===2H2O)
还原 2H2O+O2+4e-===4OH-(或4H++O2+4e-===2H2O)
(3)反应放热,温度升高
(4)①药品用量和操作同编号①实验(多孔橡皮塞增加进、出导管);
②通入氩气排净瓶内空气;
③滴入醋酸溶液,同时测量瓶内压强变化(也可测温度变化、检验Fe2+等)。如果瓶内压强增大,假设一成立。否则假设一不成立。(本题属于开放性试题,答案合理即可)
解析 (1)本题采用“控制变量法”进行研究,即保持其他条件相同,只考虑其中一个因素对实验的影响。探究醋酸浓度对电化学腐蚀的影响时,应保证碳粉和铁粉的质量与参照实验相同,因此实验②中铁粉为2.0 g;对比实验①和③可知,铁粉的质量及醋酸的浓度相同,而碳粉的质量不同,显然探究的是碳粉的含量对铁的电化学腐蚀的影响。
(2)当铁发生析氢腐蚀时,由于生成H2,容器的压强不断增大,而发生吸氧腐蚀时,由于消耗O2,容器的压强不断减小,t2时容器的压强明显小于起始压强,说明铁发生了吸氧腐蚀,此时Fe作负极,失去电子发生氧化反应;碳粉作正极,O2在其表面得到电子发生还原反应,电极反应式为O2+2H2O+4e-===4OH-(或4H++O2+4e-===2H2O)。
(3)Fe发生电化学腐蚀时,放出热量,使体系的温度升高。
(4)参照实验①中药品的用量及操作方法,更换多孔橡皮塞,增加进、出气导管,并通入稀有气体,排出空气,滴加醋酸溶液,同时测量瓶内压强的变化、温度变化等,确定猜想一是否成立。


科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
 b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
b.晶体中共价键的键长:金刚石中C-C<石墨中C-C
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
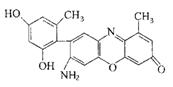
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,第一电离能由小到大的顺序是 ,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2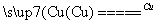 NF3+3NH4F
NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体,
②NF3与NH3均为三角锥形,但前者键角小于后者,原因是
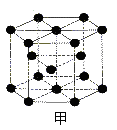 ③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。
③周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有 个该元素,金属铜采取如图乙所示堆积方式,可称为____ 堆积。

乙
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的钢铁腐蚀中,下列说法正确的是( )
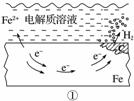
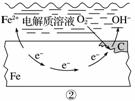
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O===4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
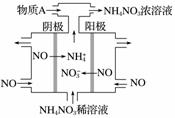
电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中不正确的是( )
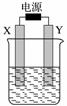
A.X电极是阴极
B.Y电极产生气体的体积为0.28 L
C.电解后溶液的pH=1
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
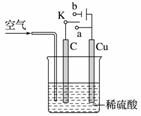
(1)甲同学认为在通入空气的同时,将开关K与______(填“a”或“b”)连接,即可实现。则此时石墨电极的反应式为__________________,电池的总反应式为________________________。电池工作时,H+向________(填“C”或“Cu”)极移动。
(2)乙同学认为,不通入空气,将K与______(填“a”或“b”)连接,也可以实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。若标准状况下产生2.24 L气体,则电路中转移的电子为______mol。
(3)丙同学认为还可以用如图所示装置模拟工业上电镀铜。他认为只要将C换成Fe(Cu足量),并将乙同学的实验持续足够长时间,即可实现在Fe上镀Cu。你认为他的想法______(填“正确”或“不正确”),理由是______________。这种方法得到的铜镀层______(填“牢固”或“不牢固”),理由是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用电子式表示。
①铝原子_________________ ②硫离子_________________
③溴化镁的形成过程
(2)在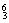 Li、
Li、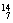 N、
N、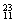 Na、
Na、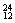 Mg、
Mg、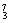 Li、
Li、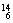 C中:
C中:
① 和 互为同位素。
② 和 质量数相等,但不能互称同位素。
③ 和 的中子数相等,但质子数不相等,所以不是同一种元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
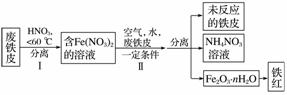
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为___________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
________________________________________________________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com