
分析 若溶液中铝元素为铝离子,由Al元素守恒可知氢氧化铝的物质的量,若溶液中Al元素以AlO2-形式存在,根据由Al元素守恒可知AlO2-的物质的量,先判断溶液中的铝元素存在形式,再根据离子守恒计算即可.
解答 解:若取某浓度的NaOH溶液50.0mL与50.0mL 2.00mol•L-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,若溶液中铝元素为铝离子,由Al元素守恒可知,氢氧化铝的物质的量=0.05L×2mol/L×$\frac{1}{2}$=0.05mol,根据氢氧根离子守恒,n(NaOH)=3n[Al(OH)3]=0.05mol×3=0.15mol,故NaOH的物质的量浓度=$\frac{0.15mol}{0.05L}$=3mol/L,若溶液中Al元素以AlO2-形式存在,根据由Al元素守恒可知,AlO2-的物质的量=0.05mol×2mol/L×$\frac{1}{2}$=0.05mol,溶液为NaCl、NaAlO2混合溶液,根据钠离子、离子守恒可知:n(NaOH)=n(NaCl)+n(NaAlO2)=3n(AlCl3)+n(NaAlO2)=3×0.05mol×2mol/L+0.05mol=0.35mol,故NaOH的浓度=$\frac{0.35mol}{0.05L}$=7mol/L,
故答案为:3或7.
点评 本题考查了物质的量浓度的有关计算,难度不大,如果在计算题中反应物的物理量都是已知的,注意要先进行过量计算,然后根据不足量的为标准计算即可.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 制乙烯:浓硫酸、乙醇,用酒精灯迅速加热至170℃ | |
| B. | 制硝基苯:浓硝酸、浓硫酸、苯,用55~60℃水浴加热 | |
| C. | 制乙酸乙酯:乙醇、浓硫酸、冰醋酸,用酒精灯缓慢加热 | |
| D. | 制酚醛树脂:苯酚、40%的甲醛溶液、浓盐酸,用沸水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
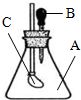 如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )
如图所示,锥形瓶内装有干燥的气体A,胶头滴管内盛有液体B,若挤压胶头滴管,使液体B滴入瓶中,振荡,一会儿可见小气球C鼓起.则对于气体A和液体B最可能的是( )| A. | A是Cl2,B是饱和NaCl溶液 | B. | A是NH3,B是酚酞溶液 | ||
| C. | A是H2,B是水 | D. | A是CO2,B是NaHCO3饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: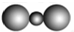 | B. | H2O2的电子式: | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol•L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
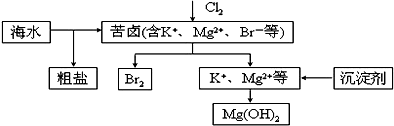 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
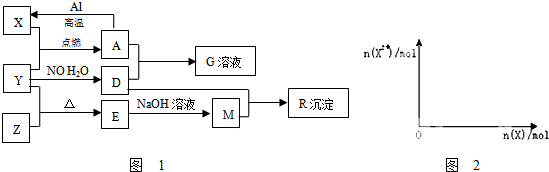
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
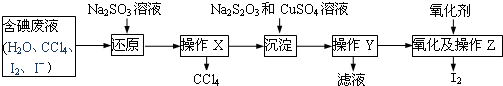
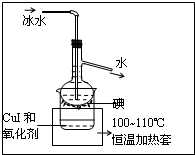
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com