
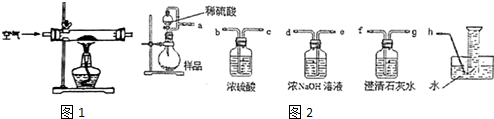
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
分析 (1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,而碳酸氢钠受热分解;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积;用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去;
(3)称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算,或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.
解答 解:(1)①钠与氧气反应可以得到氧化钠、过氧化钠,二者均与二氧化碳反应得到碳酸钠,与水反应会得到氢氧化钠,由信息可知钠与氮气不反应,而碳酸氢钠受热分解,Na2O2中可能含有的杂质为Na2CO3、Na2O、NaOH,
故答案为:bcd;
②烧瓶中过氧化钠与硫酸反应生成硫酸钠、氧气与水,反应方程式为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O,
分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,还可以抵消滴加硫酸排出空气的体积,若没有该导管,排出的空气按生成氧气的体积计算,导致测定氧气体积偏大,则测定Na2O2样品的纯度偏大,
用浓氢氧化钠溶液吸收可能氧气中混有二氧化碳,澄清石灰水检验二氧化碳是否除尽,用排水法收集氧气,根据氧气体积可以计算过氧化钠的质量,进而计算样品中过氧化钠的质量分数,测定装置的接口从左至右正确的连接顺序是aedfgh,
故答案为:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;偏大;aedfgh;
(2)实验I说明中间产物为过氧化氢,且过氧化氢没有完全分解为氧气,导致测定氧气体积偏小,从而导致测定结果偏小;
实验Ⅱ:反应后的溶液中有硫酸剩余,可以使红色酚酞溶液褪色;
实验Ⅲ:加入的氢氧化钠先中和剩余的硫酸,过量的氢氧化钠式溶液显红色,过氧化氢具有强氧化性,又使溶液红色褪去,反应溶液中存在的中间产物与酚酞作用的条件是碱性条件,
故答案为:偏小;I;碱性条件;
(3)称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.]
故答案为:称取一定质量的样品(m),加热733~873K使之分解,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.[或者称取一定质量的样品(m),进入少量二氧化锰,再进入足量的水,用量气装置测定常温常压下生成氧气体积(V),然后进行有关计算.].
点评 本题考查物质制备实验、物质含量测定、探究实验等,侧重考查学生对测定原理的理解分析,注意定量实验中准确性问题.


科目:高中化学 来源: 题型:解答题
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60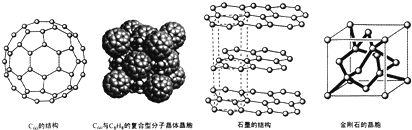
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未成熟苹果的果肉遇碘水会变蓝 | |
| B. | 与锌块相连或与电源正极相连,钢铁一定能被保护 | |
| C. | 纤维素和油脂均可发生水解,都属于天然高分子化合物 | |
| D. | 加酶洗衣粉可以很好的洗涤毛织品上的污渍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2C1O-+H2O+SO2═CaSO3↓+2HC1O | |
| C. | 氢氧化钙溶液气碳酸氢镁溶液反应:Ca2++OH-+HCO3 -═CaCO3↓+H2O | |
| D. | 硫酸亚铁的酸性溶液中加入H2O2溶液:Fe 2++H2O2+2H+═Fe 3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com