
| A.凯库勒——苯的发现和提出苯分子结构学说 |
| B.科里——提出有机合成逆合成分析原理 |
| C.门捷列夫——由无机物合成有机物,打破了有机物的生命力学说 |
| D.阿伏加德罗——提出原子—分子学说 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
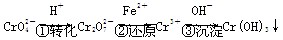
 Cr2O(橙色)+H2O
Cr2O(橙色)+H2O Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| pH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol·L-1 |
| 细菌总数 | <100个/mL |
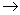 曝气池
曝气池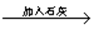 一级沉降池
一级沉降池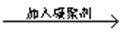 二级沉降池
二级沉降池 过滤池
过滤池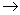 自来水
自来水查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应(1)中SO2氧化性比HI强 |
| B.循环过程中需要补充H2O |
| C.循环过程H2O作催化剂 |
| D.循环过程中产生1mol H2的同时产生0.5mol O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 以上反应中,最节能的是 ,原子利用率最高的是 。
以上反应中,最节能的是 ,原子利用率最高的是 。
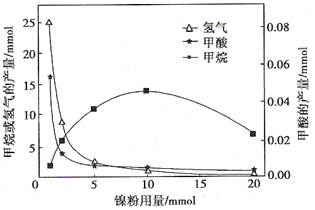

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com