
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合溶液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 1∶2 B. 3∶1
C. 2∶1 D. 6∶1
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取并提纯乙酸乙酯的方案如下所示
已知:①氯化钙可与乙醇形成CaCl26C2H5OH;
②有关有机物的沸点如下表所示
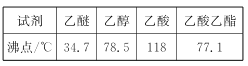
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程:装置如图所示,A中盛有浓硫酸,B中盛有9.5mL无水乙醇和6mL冰醋酸,D中盛有饱和碳酸钠溶液。
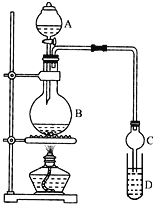
(1)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是_____(填字母代号)
A. 25 mL B 50 mL C. 250 mL D. 500 mL
(2)球形干燥管的主要作用是_______________。
(3)饱和碳酸钠溶液的作用是______(填字母代号)。
A.消耗乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
II.提纯方法:
①将D中混合液进行分离。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,选用合适的干燥剂干燥,得到粗产品。
③将粗产品蒸馏,收集77.1℃时的馏分,得到纯净、干燥的乙酸乙酯。
(4)第①步分离混合液时,选用的主要玻璃仪器的名称是_____________。
(5)第②步中用饱和食盐水洗去碳酸钠后,再用饱和氯化钙溶液洗涤,主要洗去粗产品中的______(填物质名称)。再加入_______(此空从下列选项中选择,四种物质均有吸水性)干燥
A.浓硫酸 B.碱石灰 C.无水硫酸钠 D.生石灰
(6)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,一个可能的原因是_____________________________________________。
(7)若实验所用乙酸的质量为2.4g,乙醇的质量为2.1g,得到纯净的产品的质量为2.64g,则乙酸乙酯的产率是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
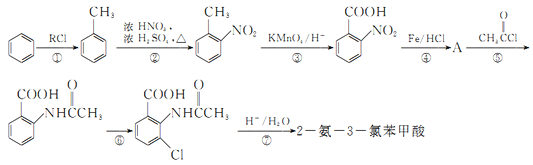
已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
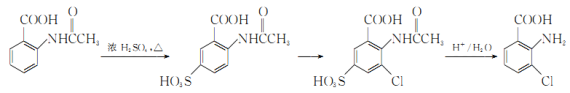
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是
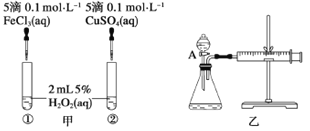
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞。将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子的说法中,正确的是
A.原子不显电性,说明原子内的质子数等于中子数
B.同种原子内的质子数相同
C.含有相同中子数的原子,一定是同一类的原子
D.原子是最小的粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:其中A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:

(1)“C6H12O6”的名称是________,工业上由石蜡制取A的方法称作____。C中含有官能团名称是____________;
(2)A→B反应类型为_________________;C→D反应类型为_________________;
(3)写出下列转化的化学方程式
①A→B:__________________;
②C→D:___________________________;
③CH3CH2OH→CH3CHO:_________________________。
(4)已知A能使酸性高锰酸钾褪色,还原产物为Mn2+,写出该氧化还原反应的离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为短周期元素,它们在周期表中的位置如下图。若A原子的最外层电子数是次外层电子数的2倍。下列说法中正确的是

A. D的单质常用做半导体材料
B. 最简单气态氢化物的热稳定性:A>B
C. B的最低负化合价:-2价
D. 原子半径大小:r(C)>r(B)>r(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com