
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
 ;由于SCl2在常温下为液态,故为分子晶体,故答案为:
;由于SCl2在常温下为液态,故为分子晶体,故答案为: ;分子;
;分子;| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
| ||
16
|
| M | ||
4
|
| M | ||
4
|


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:

| ① | ② | ③ | ④ | |
| A | NaCl | Na2SO4 | KCl | Mg(NO3)2 |
| B | Na2SO4 | K2SO4 | KCl | MgCl2 |
| C | NaCl | K2SO4 | KCl | MgCl2 |
| D | Na2SO4 | K2SO4 | KCl | Mg(NO3)2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
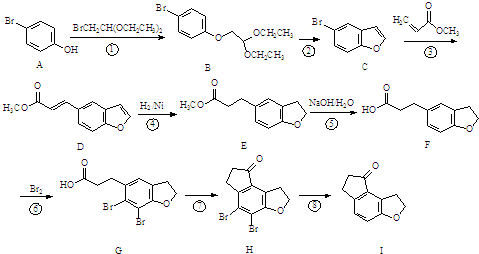
| PDC/DMF |
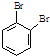 为原料,合成
为原料,合成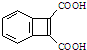 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成| HBr |
| NaOH溶液 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
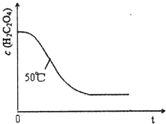 某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.
某小组利用H2C204溶液和酸性KMn04溶液反应来探究“条件对化学反应速率的影响”.| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMnO4溶液 | H2O | ||
| V/mL | c/(mol?L-1) | V/mL | c/(mol?L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度 g/100gH2O | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称重时发现砝码生锈 |
| B、定容时观察液面俯视 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量的蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com