
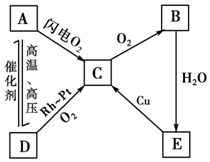
 ��ͼ��ʾ����A��B��C��D��E���ֺ������ʵ�ת����ϵͼ������A��B��C��D�����¶������壬BΪ����ɫ��д��A��B��C��D��E�Ļ�ѧʽ������Ӧ�Ļ�ѧ����ʽ��
��ͼ��ʾ����A��B��C��D��E���ֺ������ʵ�ת����ϵͼ������A��B��C��D�����¶������壬BΪ����ɫ��д��A��B��C��D��E�Ļ�ѧʽ������Ӧ�Ļ�ѧ����ʽ������ ��A��B��C��D��E���ֺ������ʵ�ת����ϵͼ������A��B��C��D�����¶������壬BΪ����ɫ����֪BΪNO2�����ͼ��ת����֪AΪN2��CΪNO��DΪNH3��EΪHNO3���Դ������
��� �⣺��1��������������֪��A��B��C��D��E�ֱ�ΪN2��NO2��NO��NH3��HNO3��
�ʴ�Ϊ��N2��NO2��NO��NH3��HNO3��
��2��A��C�ķ�ӦΪ����������ת����NO�ķ�Ӧ�������ڷŵ�������¿��Ժ�����֮�䷴Ӧ����һ����������Ӧ�Ļ�ѧ����ʽΪN2+O2$\frac{\underline{\;�ŵ�\;}}{\;}$2NO��
D��CΪ�����Ĵ�������Ӧ������ʽΪ4NH3+5O2$\frac{\underline{\;\;����\;\;}}{���¸�ѹ}$4NO+6H2O��
B��EΪ����������ˮ��Ӧת�������ᣬ��Ӧ�Ļ�ѧ����ʽΪ3NO2+H2O�T2HNO3+NO��
E��CΪCu������ķ�Ӧ������ʽΪ8HNO3+3Cu=3Cu��NO3��2+2NO��+4H2O��
�ʴ�Ϊ��N2+O2$\frac{\underline{\;�ŵ�\;}}{\;}$2NO��4NH3+5O2$\frac{\underline{\;\;����\;\;}}{���¸�ѹ}$4NO+6H2O��3NO2+H2O�T2HNO3+NO��8HNO3+3Cu=3Cu��NO3��2+2NO��+4H2O��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬����ͼ��ת����Ԫ�ػ�����֪ʶΪ�����ؼ������ط������ƶ������Ŀ��飬ע��BΪ�ƶϵ�ͻ�ƿڣ���Ŀ�ѶȲ���


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ʼ���ʵ��� | �� | �� | �� |
| n��H2��/mol | 1 | 2 | 2 |
| n��I2��/mol | 1 | 1 | 2 |
| A�� | ƽ��ʱ�����л�������ƽ��Ħ�������Ǽ��е�2�� | |
| B�� | ƽ��ʱ��������HI�����ʵ���n��������2n���ң� | |
| C�� | ƽ��ʱ������I2��ת���ʴ���80% | |
| D�� | ��Ӧ��ʼʱ�����еķ�Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
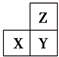
| A�� | �����Ǿ�Ϊ����Ԫ�أ���X��Y����Ԫ����ɵ�����һ���Ǽ��������� | |
| B�� | �����ǵ�ԭ������������֮��Ϊ11�������Ǿ�Ϊ�ǽ���Ԫ�� | |
| C�� | �����Ǿ����ǽ���Ԫ�أ���ǽ����ԣ�Z��Y��X | |
| D�� | ZԪ�ص�����ϼ۲�һ������XԪ�ص�����ϼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
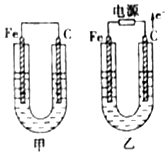 �ס������ص缫���϶���������̼������ش��������⣺
�ס������ص缫���϶���������̼������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1 mol CO2ͨ������NaOH��Һ������Һ����������ĿΪ0.1 NA | |
| B�� | ��״���£���11.2 L��Cl2ͨ��������NaOH��Һ�У�ת�Ƶĵ�����ΪNA | |
| C�� | 0.1 mol N2������H2��Ӧ��ת�Ƶĵ�����Ϊ0.6 NA | |
| D�� | 4.6g��NO2��N2O4��ɵĻ�����к�����ԭ�ӵ���ĿΪ0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
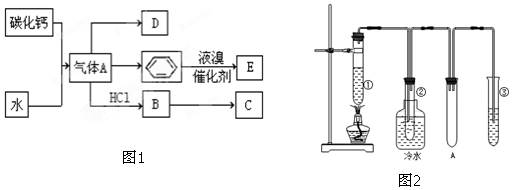
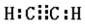 ��
�� ���䷴Ӧ����Ϊ�Ӿ۷�Ӧ��
���䷴Ӧ����Ϊ�Ӿ۷�Ӧ��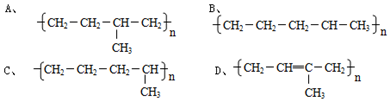
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| H2��mol/L�� | Cl2��mol/L�� | V��mol/L•S�� |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A�� | m=1��n=2 | B�� | m=$\frac{1}{2}$��n=$\frac{1}{2}$ | C�� | m=1��n=$\frac{1}{2}$ | D�� | m=$\frac{1}{2}$��n=1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
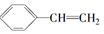 ��������������������ȷ���ǣ�������
��������������������ȷ���ǣ�������| A�� | �٢ڢܢ� | B�� | �٢ڢݢޢ� | C�� | �٢ڢܢݢ� | D�� | �٢ڢۢܢݢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
| A�� | ��ͬŨ��CH3COONa��Na2CO3�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c��Na+����c��CO32-����c��CH3COO-����c��OH-����c��H+�� | |
| B�� | ̼������Һ�еμ�������ˮ�����ӷ���ʽΪCO32-+Cl2+H2O�THCO3-+Cl-+HClO | |
| C�� | ��0.1mol•L-1 HClO��Һ�еμ�NaOH��Һ��c��HClO����c��ClO-��=1��3����ʱ��ҺpH=8 | |
| D�� | ��Ũ�Ⱦ�Ϊ1��10-3mol•L-1��KCl��K2CrO4���Һ�еμ�1��10-3mol•L-1��AgNO3��Һ��CrO42-���γɳ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com