
【题目】0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度 .
(2)c(Na+)+c(H+)═ .
(3)c(Na+)═ .
【答案】
(1)c(Na+)>c(HCO ![]() )>c(OH﹣)>c(H+)>c(CO
)>c(OH﹣)>c(H+)>c(CO ![]() )
)
(2)c(HCO ![]() )+c(OH﹣)+2c(CO
)+c(OH﹣)+2c(CO ![]() )
)
(3)c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)
)+c(H2CO3)
【解析】解:(1)碳酸氢钠溶液中,碳酸氢根离子的水解程度大于其电离程度,溶液呈碱性,则c(OH﹣)>c(H+)、c(Na+)>c(HCO ![]() ),溶液中离子浓度大小为:c(Na+)>c(HCO
),溶液中离子浓度大小为:c(Na+)>c(HCO ![]() )>c(OH﹣)>c(H+)>c(CO
)>c(OH﹣)>c(H+)>c(CO ![]() ),所以答案是:c(Na+)>c(HCO
),所以答案是:c(Na+)>c(HCO ![]() )>c(OH﹣)>c(H+)>c(CO
)>c(OH﹣)>c(H+)>c(CO ![]() );(2)根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO
);(2)根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO ![]() )+c(OH﹣)+2c(CO
)+c(OH﹣)+2c(CO ![]() ),所以答案是:c(HCO
),所以答案是:c(HCO ![]() )+c(OH﹣)+2c(CO
)+c(OH﹣)+2c(CO ![]() );(3)根据碳酸氢钠溶液的物料守恒可得:c(Na+)=c(HCO
);(3)根据碳酸氢钠溶液的物料守恒可得:c(Na+)=c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3),所以答案是:c(HCO
)+c(H2CO3),所以答案是:c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3).
)+c(H2CO3).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4) 实验室可用熔融的锡(熔点为23.9℃)与Cl2反应制备SnCl4,装置如下图所示回答下列问题:
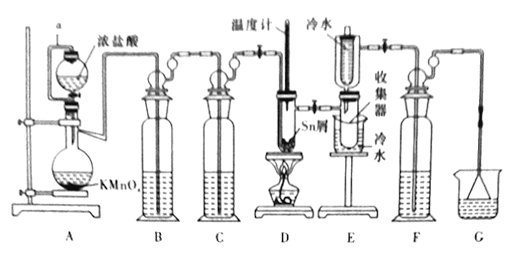
已知SnCl4在湿空气中极易水解生成SnO2·xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)a管的作用是________,装置A中发生反应的化学方程式是______________。
(2)装置B、C、F、G中盛放的最佳试剂依次为____________(填序号,试剂可重复使用)。
①饱和Na2CO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______________。
(4)若撒去装置C,则装置D中可能会发生的主要副反应的化学方程式为___________。
(5)得到的产物中常混有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取mg产品于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol/L碘标准溶液滴定至终点,达到滴定终点时的现象为________,消耗碘标准溶液20.00mL,计算产品中SnCl4的含量______(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
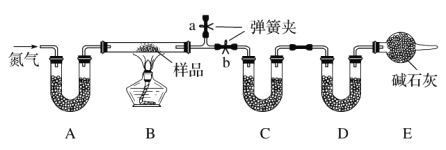
(1)加热前通入氮气的目的是__________,操作方法为_______________。
(2)装置A、C、D中盛放的试剂分别为A_____,C_____,D_____。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_____(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将_____;若撤去E装置,则测得Na2CO3·10H2O的含量将_____。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:

(1)保存过氧化氢的试剂瓶上最适合贴的标签是_____________(填字母)。
(2)下列反应中,H2O2体现还原性的是______________。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
D.K2Cr2O7+4H2O2+2H+ =2CrO5+5H2O[CrO5称为过氧化铬,可写成CrO(O2)2]
(3)采矿废液中的氰化物(如KCN)一般用H2O2做无毒化处理,化学方程式为:KCN+H2O2+H2O=KHCO3+NH3↑(KCN中N为﹣3价),生成1mol NH3时转移的电子数为___________。
(4)H2O2被称为绿色氧化剂的理由是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2,还有少量含铁、铜、汞的化合物)制备MnSO4电解液继而提取锰的工业流程如下
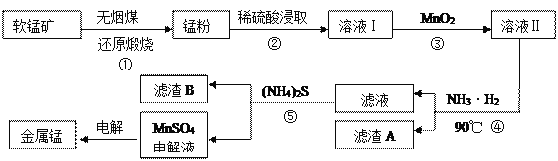
(1)已知锰粉的主要成分为MnO,反应①的化学方程式为________________________。
(2)实验室可用软锰矿与浓盐酸反应制Cl2,比较MnO2、C12、Fe3+的氧化性强弱:_______。
(3)溶液I中加入一定质量的MnO2以测定Fe2+的浓度,加入MnO2有关反应的离子方程式为___________________________________________________________________。
(4)已知90℃时水的离子积常数Kw=3.6×10-13,Fe(OH)3的Ksp=6.4×10-25,要使滤渣A沉淀完全,需用氨水调pH至少为______(已知lg 3≈0.5)。
(5)溶液Ⅰ的主要成分为 ____________。滤渣B的主要成分为_________________。
(6)工业上用二氧化锰制备高锰酸钾,先用二氧化锰制得锰酸钾,再用惰性电极电解锰酸钾溶液得到高锰酸钾,电解时阳极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A.室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO﹣)>c(Na+)
B.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl﹣)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH ![]() )=c(K+)=c(Ba2+)
)=c(K+)=c(Ba2+)
D.0.2mol?L﹣1某一元弱酸HA溶液和0.1mol?L﹣1NaOH溶液等体积混合后的溶液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com