
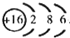
分析 根据非金属单质可以实现上述题目转化的分别有C、S、N2,2C+O2=2CO、2CO+O2=2CO2;S+O2=S02、2SO2+O2=2SO3;N2+O2=2NO、2NO+O2=2NO2;D为强酸,则不会是碳单质的转化;
(1)若A是常温下的淡黄色固体,A是非金属单质,判断为S,B是有刺激性气味的无色气体可知B为二氧化硫,然后依据题目可以准确做出答案;
(2)若A在常温下为气体,C是红棕色气体证明为NO2,判断A为N2;发生反应为:N2+O2=2NO、2NO+O2=2NO2;结合判断出的物质分析回答问题.
解答 解:根据非金属单质可以实现上述题目转化的分别有C、S、N2,2C+O2=2CO、2CO+O2=2CO2;S+O2=S02、2SO2+O2=2SO3;N2+O2=2NO、2NO+O2=2NO2,D为强酸,则不会是碳单质的转化,
I.若A是常温下的淡黄色固体,A是非金属单质,判断为S,B是有刺激性气味的无色气体可知B为二氧化硫SO2,C为SO3,D为H2SO4,
(1)A单质为S,A的原子结构示意图为: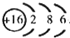 ,
,
故答案为: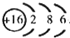 ;
;
(2)D的浓溶液为浓硫酸,在加热的条件下可与Cu反应,该反应的化学方程式为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
II.若A在常温下为气体,C是红棕色气体证明为NO2,判断A为N2;发生反应为:N2+O2=2NO、2NO+O2=2NO2;3NO2+H2O=2HNO3+NO,
(1)C→D的反应为3NO2+H2O=2HNO3+NO;,反应中氧化剂为二氧化氮,还原剂为二氧化氮,依据化合价变化计算,氧化剂和还原剂物质的量之比为:1:2,
故答案为:1:2.
点评 本题考查无机物的推断,题目难度中等,本题中物质的颜色以及连续发生氧化反应的特征为突破口进行推断,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al<Mg<Na | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: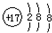 | |
| B. | 作为相对原子质量测定标准的碳核素为${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: | |
| D. | HClO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
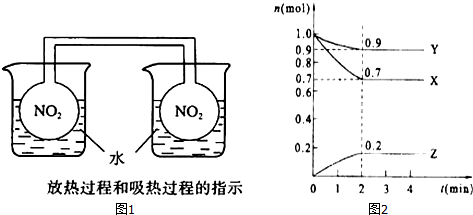
 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相同的NaCl溶液和NaClO溶液,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| B. | 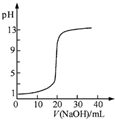 如图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 中和同体积、同浓度的盐酸时,消耗pH相同的氨水、氢氧化钠和氢氧化钡溶液的体积大小关系是:氨水<氢氧化钡<氢氧化钠 | |
| D. | 在NaH2PO4水溶液中存在关系:C(H3PO4)+C(H+)═C(HPO42-)+C(PO43-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由反应:2Fe2++Cl2→2Fe3++2Cl-,可以得出还原性Cl2<Fe3+ | |
| B. | 由于钢铁表面水膜里溶有氧气和二氧化碳,所以日常的金属腐蚀以析氢腐蚀为主 | |
| C. | 将钢铁接在外电源的负极上,另一金属(不是惰性金属)接在外电源的正极上组成电解池,可以防钢铁腐蚀 | |
| D. | 纯锌与稀硫酸反应比不纯的锌(一般含铁、铜等杂质)与相同的稀硫酸反应慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ( D)=0.4 mol/(L•s) | B. | v( C)=0.8mol/(L•s) | C. | υ( B)=0.6 mol/(L•s) | D. | υ( A)=0.5 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com