
有下列离子晶体空间示意图:(·阳离子,∘阴离子):
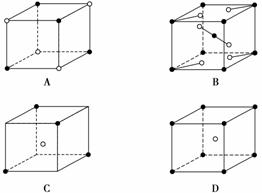
以M代表阳离子,以N表示阴离子,写出各离子晶体的组成表达式:A__________、B__________、C________、D________。
科目:高中化学 来源: 题型:
分子晶体在通常情况下不具有的性质是( )
A.晶体构成微粒是分子
B.干燥或熔化时均能导电
C.微粒间以范德华力结合
D.熔点、沸点一般低于原子晶体和离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,
B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有1个电子。
(1)C原子的电子排布式为________________________________________________,
若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合
物中的共价键属于________键。
(2)当n=2时,B的原子结构示意图为__________,B与C形成的化合物晶体属于____________晶体。当n=3时,B与C形成的化合物的晶体中微粒间的作用力是_____。
(3)

若D元素与Fe形成某种晶体,该晶体的晶胞结构如右图所示,则晶体的化学式是___(用元素符号表示);若晶胞的边长为a nm,则合金的密度为______________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B为两种短周期元素,A的原子序数大于B,且B原子的最外层电子数为A原
子最外层电子数的3倍。A、B形成的化合物是中学化学常见的化合物,该化合物熔融
时能导电。试回答下列问题:
(1)A、B的元素符号分别是________、________。
(2)用电子式表示A、B元素形成化合物的过程:_____________________________
________________________________________________________________________。
(3)A、B所形成的化合物的晶体结构与氯化钠晶体结构相似,则每个阳离子周围吸引了
________个阴离子;晶体中阴、阳离子数之比为__________。
(4)A、B所形成化合物的晶体的熔点比NaF晶体的熔点________,其判断的理由是
________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定微粒的个数比为2∶1的是( )
A.Be2+离子中的质子和电子
B. H原子中的中子和质子
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiC NaCl CCl4 CF4
B.SiC NaCl CF4 CCl4
C.NaCl SiC CCl4 CF4
D.CF4 CCl4 NaCl SiC
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于晶体的性质叙述中,不正确的是( )
A.晶体的自范性指的是在适宜条件下晶体能够自发地呈现封闭规则的多面体几何外形
B.晶体的各向异性和对称性是矛盾的
C.晶体的对称性是微观粒子按一定规律做周期性重复排列的必然结果
D.晶体的各向异性直接取决于微观粒子的排列具有特定的方向性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com