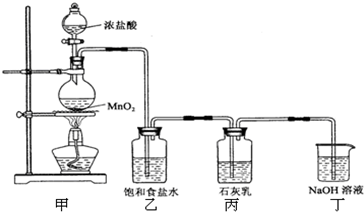
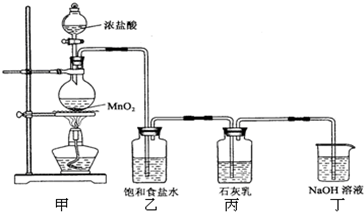
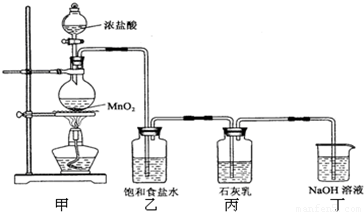
足量的浓盐酸与4.35g MnO2混合加热,向反应后的溶液中加入106g10%的Na2CO3溶液,恰好不再产生气体,再向溶液中加入过量的AgNO3溶液.求:(1)标准状况下产生Cl2的体积 (2)生成AgCl沉淀的质量.
【答案】
分析:发生反应的化学方程式有:MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O,Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑,根据方程式结合质量守恒计算.
解答:解:(1)4.35g MnO
2的物质的量为n( MnO
2)=

=0.05mol,
MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O
1mol 1mol 22.4L
0.05mol 0.05mol V
V=

=1.12L,
答:标准状况下产生Cl
2的体积为V(Cl
2)=1.12L.
(2)106g10%的Na
2CO
3溶液中n(Na
2CO
3)=
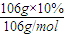
=0.1mol,
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
1mol 2mol
0.1mol n(NaCl)
n(NaCl)=0.2mol,
又n(MnCl
2)=0.05mol,
所以:反应后溶液中n(Cl
-)=0.2mol+2×0.05mol=0.3mol,
Cl
-+Ag
+=AgCl↓
0.3mol 0.3mol
可得:n(AgCl)=0.3mol,
m(AgCl)=0.3mol×143.5g/mol=43.05g,
答:生成AgCl沉淀的质量为43.05g.
点评:本题考查化学方程式的计算,题目难度不大,注意有关化学方程式的书写.

 MnCl2+Cl2↑+2H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据方程式结合质量守恒计算.
MnCl2+Cl2↑+2H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据方程式结合质量守恒计算. =0.05mol,
=0.05mol, MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O =1.12L,
=1.12L,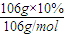 =0.1mol,
=0.1mol,


 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O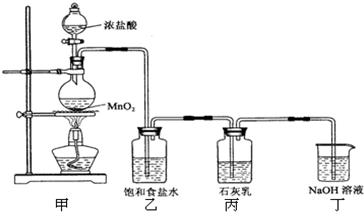
 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O