
【题目】甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ/mol
CH3OH(g)+H2O(g) △H=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41 kJ/mol
CO(g)+H2O(g) △H=+41 kJ/mol
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | x |
则x=_________。
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。

①T℃时状态Ⅰ条件下,0~3min内CH3OH的平均反应速率v=_____________mol/(L·min),平衡常数K=____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_______;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度________(填“>”“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2____(填“>”“<”或“=”)K3;
⑤一定温度下,此反应在恒容容器中进行,能判断该反应达到化学平衡状态依据的是_____。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
【答案】 413 0.28 0.5 增大压强 > > a c
【解析】试题分析:(1)根据盖斯定律:反应③+反应①=反应②,故△H=△H2-△H3=-58kJmol-1-(+41kJ.mol-1)=-99kJ.mol-1,反应热=反应物总键能-生成物总键能,故
△H1=1076kJ.mol-1+2×436kJ.mol-1-(3×x+343+465)kJ.mol-1=-99kJ.mol-1,解得:x=413;
(2)①有图表可知,3min时H2的物质的量为3mol,则H2变化物质的量为5mol,CH3OH的变化物质的量为![]() ,0~3min内CH3OH的平均反应速率v=
,0~3min内CH3OH的平均反应速率v=![]() =0.28mol/(L·min);8min后反应达到平衡状态,此时H2的物质的量为2mol,变化物质的量为6mol,此时平衡状态中CO2的物质的量为4mol,CH3OH的物质的量为2mol,H2O(g)的物质的量为2mol,此时平衡常数K=
=0.28mol/(L·min);8min后反应达到平衡状态,此时H2的物质的量为2mol,变化物质的量为6mol,此时平衡状态中CO2的物质的量为4mol,CH3OH的物质的量为2mol,H2O(g)的物质的量为2mol,此时平衡常数K=![]() =0.5;
=0.5;
②状态Ⅱ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强;
③状态Ⅲ反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故状态Ⅲ对应的温度>T℃;
④状态Ⅱ与状态I相同温度下发生的反应;状态Ⅲ是升高温度,温度升高平衡逆向移动,平衡常数减小,则K2>K3;
(5)a.因气态反应物与气态生成物的系数和不等,则容器中压强不变时,是平衡状态,故a正确;b.随着反应的进行,甲醇和水蒸汽的体积比可能始终保持不变,则不一定是平衡状态,故b错误;c.当v正(H2)=3v逆CH3OH) 时,反应达到平衡状态,故b正确;d.C=O断裂和H—H断裂都说明反应正向进行,不能说明是平衡状态,故d错误;答案为ac。


科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究:下表是该实验小组研究影响H2O2分解速率的因素时
记录的一组数据:用10mL H2O2制取150mL(标准状况下)O2所需的时间(s)
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂加热 | 360 | 480 | t | 720 |
MnO2催化剂加热 | 10 | 25 | 60 | 120 |
(1)①该实验小组在设计方案时,考虑了浓度、、等因素对H2O2分解速率的影响.
上述因素对H2O2分解速率的影响分别是:
②推测t(s)的范围为 .
(2)下列有关催化剂的说法中正确的是(填序号)
A.催化剂不参与反应,反应前后催化剂的性质和质量都不变
B.催化剂在化学反应前后化学性质和质量都不变
C.催化剂能使不起反应的物质发生反应
D.催化剂能改变化学反应速率
E.任何化学反应都需要催化剂
F.催化剂具有高度的选择性(或专一性)
(3)将质量相同但聚集状态不同的MnO2分别加入15mL 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
催化剂MnO2 | 操作情况 | 观察结果 | 反应完成所需时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
①写出上述实验中发生反应的化学方程式 .
②实验结果表明,催化剂的催化效果与有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH﹣H键吸收的能量为436KJ,形成1molH﹣H键放出的能量为391KJ,根据化学方程式N2+3H2 ![]() 2NH3 , 反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
2NH3 , 反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
A.431KJ
B.649KJ
C.869KJ
D.945.6KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________,A的转化率为________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________(填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________(填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则 :
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________;
③电池放电后,溶液的pH不断________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 28g氮气所含有的原子数目为NA
B. 化学反应中1mol金属镁变成镁离子时失去电子数目为2NA
C. 标准状况下,22.4L水中含有个水分子NA
D. 标准状况下,22.4L氯化氢所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.热化学方程式的计量数只表示分子的个数
B.热化学方程式中只需标明生成物的状态
C.反应热指的是反应过程中放出或吸收的热量
D.有能量变化的一定是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )
A. 硫酸、纯碱、石膏 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个研究性学习小组分别进行探究性的实验:
甲组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图所示的实验装置。
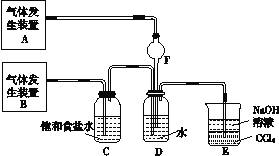
(1)气体发生装置A中产生的气体化学式为_______________________________。
(2)装置D中发生反应的化学方程式为__________________________________;
(3)装置E的作用是___________________________________________________。
乙组:为了分别研究SO2和Cl2的性质,设计了如图所示的实验装置。
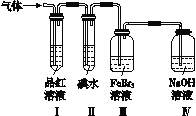
(4)当通入SO2时,装置Ⅲ中发生反应的离子方程式为________________;该反应中SO2表现出__________性。
(5)若装置Ⅱ中装有5.0 mL 1.0×10-3 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5 mol电子,则该反应的化学方程式为_____________________________。
(6)你认为乙组设计的装置是否有不足之处?__________(填“有”或“无”)。如果有,请写出改进方法:______________________________(如果无,此空不答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com