
| A、能使pH试纸呈红色的溶液:Na+、NH4+、Cl-、NO3- |
| B、滴入KSCN溶液显血红色的溶液:K+、Na+、CO32-、I- |
| C、能与铝反应产生H2的溶液:K+、Fe2+、Cl-、NO3- |
| D、常温下由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
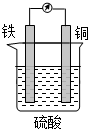
| A、该电池工作时电能转变为化学能 |
| B、铜片的质量增加 |
| C、H+向铁片移动 |
| D、铁片上发生的反应是Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )
甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )| A、该物质属于芳香烃,是苯的同系物 |
| B、所有的碳原子可能在同一平面 |
| C、此物质属于高分子化合物 |
| D、此分子的一氯取代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g O2和16g O3含有的原子数均为NA |
| B、9g重水所含有的电子数为5NA |
| C、100mL 0.1mol/L的Na2SO4溶液中含SO42-的个数为0.01NA |
| D、常温常压下,1mol H2所含的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 |
| B、工业制漂白粉 |
| C、氯碱工业制氯气 |
| D、Na2O2+2HCl═2NaCl+H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉长时间露置空气中会变质失效 |
| B、澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C、高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D、金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com