
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
分析 A.1mol氮气含有2molπ健;
B.在金刚石中每个C原子可形成的C-C键数目为4个;每条C-C键被两个C原子共用;
C.溶液的体积不确定;
D.3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O中生成8mol气体转移6mol电子.
解答 解:A.标准状况下,22.4LN2中含有π健数为2NA,故A错误;
B.每个C原子可形成的C-C键数目为4个;每条C-C键被两个C原子共有,每个碳原子可形成:4×$\frac{1}{2}$=2个C-C键,则12g金刚石即1mol,含 C-C键2mol,即个数为2NA,故B错误;
C.溶液的体积不确定,无法计算物质的量,故C错误;
D.89.6L标准状况的气体为4mol,转移的电子数为3N,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 凡是含有离子键的化合物一定是离子化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品添加剂既可以是天然物质,也可以是人工合成物质,两者使用时都要控制用量 | |
| B. | 形成酸雨的元凶主要有NOx、SO2、CO2等 | |
| C. | 人体的血脂高,是因为血液中含有的名为“血脂”的化学物质超标 | |
| D. | 我国古代化学即对人类做出了重大贡献,其中冶铁和炼钢就是其中之一,前者得到的是混合物,后者是将前者提纯得到纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫和硫铁矿均可做为原料 | |
| B. | SO2转化为SO3,需在催化剂和加热条件下进行 | |
| C. | SO3可用水直接吸收 | |
| D. | 热交换器可对生成气体冷却,对原料气体加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:
航天发射的运载火箭常用燃料肼(N2H4)和强氧化剂过氧化氢,火箭部分构件采用钛合金材料,回答下列问题:| 熔点/K | 沸点/K | 水中溶解度(标准状况下) | |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
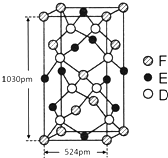 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中:SO2、NO、N2、CO2 | |
| B. | 0.1mol•L-1的NaNO3溶液中:K+、I-、Cl-、SO42- | |
| C. | 与铝反应生成大量氢气的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | 铁与稀硫酸反应后的溶液中:[Fe(CN)6]3-、NH4+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①④⑥ | C. | ④⑥⑦ | D. | ②④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦⑧ | B. | ③④⑦⑧ | C. | ②⑤⑧⑨ | D. | ④⑦⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com