
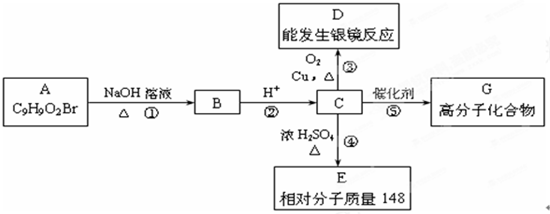
 ,B为
,B为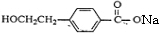 ,C为
,C为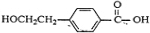 ,D为
,D为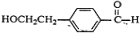 ,E为
,E为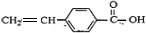 ,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物G为
,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物G为 ,据此解答.
,据此解答. ,B为
,B为 ,C为
,C为 ,D为
,D为 ,E为
,E为 ,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物G为
,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物G为 ,
, ,故答案为:氧化反应;
,故答案为:氧化反应; ;
; ,所含官能团有:醛基、碳碳双键,故答案为:醛基、碳碳双键;
,所含官能团有:醛基、碳碳双键,故答案为:醛基、碳碳双键; +2NaOH
+2NaOH| 水 |
| △ |
 +NaBr+H2O;
+NaBr+H2O;
| 浓硫酸 |
| △ |
 +H2O;
+H2O;
| 催化剂 |
 +(n-1)H2O,
+(n-1)H2O, +2NaOH
+2NaOH| 水 |
| △ |
 +NaBr+H2O;
+NaBr+H2O;
| 浓硫酸 |
| △ |
 +H2O;
+H2O;
| 催化剂 |
 +(n-1)H2O;
+(n-1)H2O; ,分子式为C9H10O3,改写为C9H4.3H2O,E为
,分子式为C9H10O3,改写为C9H4.3H2O,E为 ,分子式为C9H8O2,改写为C9H4.2H2O,现有C和E的混合物nmol,在空气中完全燃烧消耗O2 为n mol×(9+
,分子式为C9H8O2,改写为C9H4.2H2O,现有C和E的混合物nmol,在空气中完全燃烧消耗O2 为n mol×(9+| 4 |
| 4 |
| a |
| 22.4 |
| b |
| 18 |
| 5a |
| 9×22.4 |
| b |
| 18 |
| 5a |
| 9×22.4 |
| b |
| 18 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、用四氯化碳萃取溴水中的溴 |
| B、用蒸馏的方法制取蒸馏水 |
| C、用过滤的方法除食盐水中的泥沙 |
| D、用加热的方法除碳酸钠中碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| (i)B2H6 |
| (ii)H2O2/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积的盐酸和氨水的混合液 |
| B、水电离出的c(OH-)=1×10-3mol?L-1的溶液 |
| C、80℃时的氯化钠溶液 |
| D、c(H+)=1×10-3mol?L-1的酸雨c(OH-)=1×10-3mol?L-1的碱等体积混合液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com