
 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |


科目:高中化学 来源: 题型:
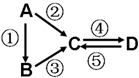 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
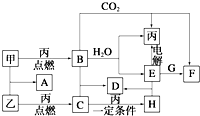 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
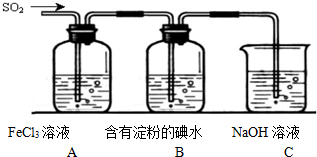
查看答案和解析>>
科目:高中化学 来源: 题型:
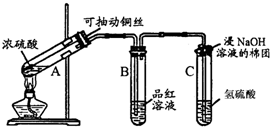
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
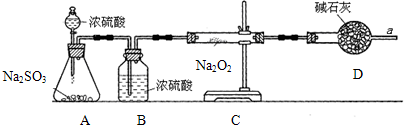
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,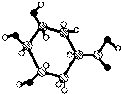 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
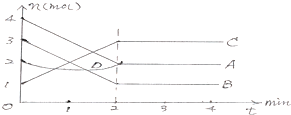
| A、该反应的方程式为:2A+2B?2C+D |
| B、该反应的方程式为:2A+2B=2C 催化剂是D |
| C、该反应是从正反应方向开始的 |
| D、平衡时,V(A)正=V(B)逆=V(C)逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com