
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 3:4 |
分析 设镁和铝的质量都是m,因酸足量,则金属都完全反应,然后利用化学反应方程式来计算氢气的质量.
解答 解:设镁和铝的质量都是m,与稀盐酸反应生成氢气的质量分别为X、Y,
Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,
24 2 54 6
m X m Y
$\frac{24}{2}$=$\frac{m}{X}$,$\frac{54}{6}$=$\frac{m}{Y}$,
X=$\frac{m}{12}$,Y=$\frac{m}{9}$,
由计算可知,相同质量的镁和铝分别与足量的稀盐酸充分反应,生成的气体的体积比是3:4.
故选D.
点评 本题考查学生利用化学反应方程式的简单计算,题目难度不大,明确酸足量,则金属完全反应是解答的关键,解答本题还可以应用关系式法、电子守恒等方法来快速解答.


科目:高中化学 来源: 题型:选择题
| A. | 烧煤时加入适量石灰石,可减少废气中SO2的量 | |
| B. | 二氧化碳是“城市空气质量日报”报道内容之一 | |
| C. | pH在 5.6~7之间的降水通常称为酸雨 | |
| D. | 某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

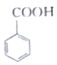 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$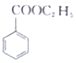 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com