
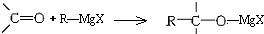 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
分析 “格氏试剂”与羰基发生加成反应,其中的“-MgX”部分加到羰基的氧上,所得产物经水解可得醇,若合成(CH3)3C-OH,即2-甲基-2-丙醇,则反应物中碳原子数之和为4,结合产物中羟基的位置分析.
解答 解:由信息: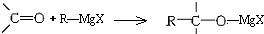 可知,此反应原理为断开C=O双键,烃基加在碳原子上,-MgX加在O原子上,产物水解得到醇,即发生取代反应,即氢原子(-H)取代-MgX,现要制取(CH3)3C-OH,即若合成2-甲基-2丙醇,则反应物中碳原子数之和为4,
可知,此反应原理为断开C=O双键,烃基加在碳原子上,-MgX加在O原子上,产物水解得到醇,即发生取代反应,即氢原子(-H)取代-MgX,现要制取(CH3)3C-OH,即若合成2-甲基-2丙醇,则反应物中碳原子数之和为4,
A、氯乙烷和乙醛反应生成产物经水解得到CH3CH(OH)CH2CH3,故A不选;
B、选项中,反应生成产物经水解得到丁醇(CH3CH2CH2CH2OH),不是丙醇,故B不选;
C、选项中,反应生成产物经水解得到2-甲基-1-丙醇,不是2-甲基-2-丙醇,故C不选;
D、丙酮和一氯甲烷反应生成产物为2-甲基-2-丙醇,故D选;
故选D.
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握题给信息,把握官能团的性质,为解答该题的关键,答题时注意审题,难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | W、X、Y三种元素最低价氢化物的稳定性依次降低 | |
| B. | X、Z、W的最高价氧化物对应的水化物酸性最强的是X | |
| C. | 五种元素均为非金属元素 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
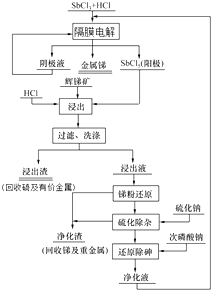
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
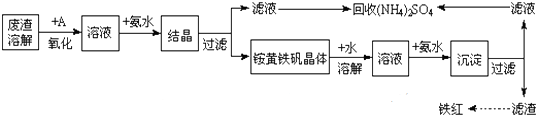
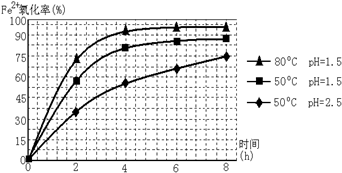
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
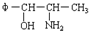 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com