
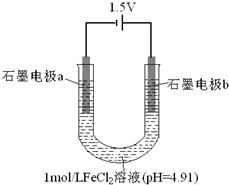
 为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)
为探究FeCl2溶液电解时阴阳极的产物,某兴趣小组用如下装置进行实验:(查阅资料:电解能否发生、电极反应及其速率,与电压大小、离子浓度等因素有关.)| 操作 | 现象和结论 |
| ①取一定量2mol/LNaCl溶液,调节溶液pH为4.91;再以相同装置进行电解. ②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液, 滴入淀粉KI溶液. | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立. |
分析 I.电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,该金属只能为Fe,则电解a亚铁离子放电生成金属铁;
II.(1)红褐色的物质为氢氧化铁,氢氧化铁与盐酸反应生成氯化铁和水;
(2)亚铁离子具有较强还原性,所以还可能亚铁离子在阳极可能直接放电生成铁离子;
(3)根据猜想①的内容,用同样浓度的NaCl溶液代替氯化亚铁,然后检验溶液中是否含有氯气生成即可,据此设计实验方案.
解答 解:I.由于电极a表面始终未出现气泡,但产生了银灰色有金属光泽的固体,则该金属只能为Fe,发生电极反应式为:Fe2++2e-=Fe,
故答案为:Fe2++2e-=Fe;
II.(1)红褐色的物质为氢氧化铁,氢氧化铁与盐酸发生反应生成氯化铁和水,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(2)亚铁离子具有较强还原性,在阳极可能直接放电生成铁离子,所以猜想2为:Fe2+在阳极直接放电生成Fe3+,
故答案为:Fe2+在阳极直接放电生成Fe3+;
(3)猜想①为Cl-在阳极放电,生成的Cl2将Fe2+氧化成Fe3+,可以设计实验,用同样浓度的NaCl溶液代替氯化亚铁,然后检验溶液中是否含有氯气生成即可,所以操作方法及现象为:①取一定量2mol/L的NaCl溶液,调节溶液pH为4.91,再以相同装置进行电解,②电解相同时间后,若电极b表面无气泡,取少量阳极附近的溶液,滴入淀粉KI溶液,若溶液不变蓝,证明猜想①不成立,若溶液变蓝,证明猜想①可能成立,
故答案为:
| 操作 | 现象和结论 |
| ①2mol/L NaCl; ②取少量阳极附近的溶液;滴入淀粉KI溶液; | 若溶液不变蓝,证明猜想①不成立 若溶液变蓝,证明猜想①可能成立 |
点评 本题考查了探究电解氯化亚铁溶液产物的方法、性质实验方案的设计等知识,题目难度中等,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握电解原理及性质实验方案设计与评价的原则.


科目:高中化学 来源: 题型:选择题
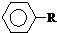 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为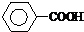 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐增大 | B. | 碱性逐渐减弱 | ||
| C. | 单质熔、沸点逐渐升高 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个信号,强度之比为1:1 | B. | 三个信号,强度之比为3:2:1 | ||
| C. | 两个信号,强度之比为3:1 | D. | 三个信号,强度之比为1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
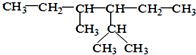 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷.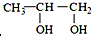 <
< 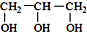 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同)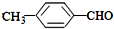 <
<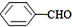
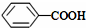 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性) ;
;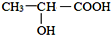 )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: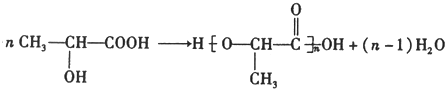 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| D. | Li是最活泼金属,F是最活泼非金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com