
| A. | Fe3 04 | B. | CuO | C. | HgS | D. | FeS |
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| D. | SO2溶于水能导电,SO2属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
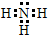 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)=c(SO42-) | |
| B. | c(Ba2+)增大,c (SO42-) 减小 | |
| C. | c(Ba2+)≠c SO42-),c(Ba2+)•c(SO42-)=KSP(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠KSP(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

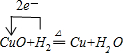
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 温度/K | 锌 | c(Zn2+)/mol/L | c(H+)/mol/L | 另加溶液 |
| A | 281 | 锌块 | 0.1 | 3 | |
| B | 308 | 锌粉 | 0.2 | 3 | 少量氯化铜 |
| C | 281 | 锌块 | 0.1 | 2 | |
| D | 308 | 锌粉 | 0.1 | 3 | 少量氯化钡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com