


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
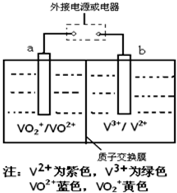 (2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )
(2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| IO | - 3 |
| S2O | 2- 3 |
| 0.01mol?L-1KIO3 酸性溶液(含淀粉) 的体积/mL |
0.01mol?L-Na2SO3 溶液的体积/mL |
H2O的 体积/mL |
实验 温度 /℃ |
溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com