
工业上由黄铜矿(主要成分CuFe S2)冶炼铜的主要流程如下:
S2)冶炼铜的主要流程如下:
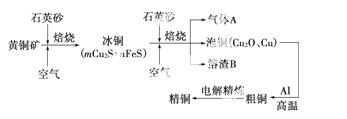
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
A.浓H2SO4 B.稀HNO3
C.NaOH溶液 D.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是__________________________________________________
__________________________________________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为__________________________________________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4== =2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,Y、Z两种元素的质子数之和为W、X两种元素的质子数之和的3倍。由此可知:
(1)元素W为________(填元素符号,下同),X为________,Y为________,Z为________。
(2)上述元素中任意三种组成的既含有离子键又含有共价键的化合物有________________________(填化学式,至少写三种)。
(3)四种元素两两组合,形成的共价化合物有________(填化学式,至少写三种)。
(4)上述四种元素可组成化合物________(填化学式),其中含有的化学键为________键和________键。
查看答案和解析>>
科目:高中化学 来源: 题型:
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是 ( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
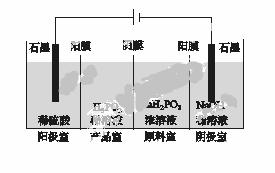
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程
B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系
C.电镀时保持电流恒定,升高温度不改 变电解反应速率
变电解反应速率
D.镀锌层破损后即对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
反应一:Ni(粗,s)+4CO(g)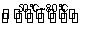 Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
反应二:Ni(CO)4(g)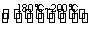 Ni(纯,s)+4CO(g) ΔH>0
Ni(纯,s)+4CO(g) ΔH>0
下列说法错误的是( )
A.对于反应一,适当增大压强,有利于Ni(CO)4的生成
B.提纯过程中,CO气体可循环使用
C.升高温度,反应一的反应速率减小,反应二的速率增大
D.对反应二,在180℃~200℃,温度越高,Ni(CO)4(g)的转化率越高
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是________。
(2)火箭残骸中常见红棕色气体,原因为:
N2O4(g)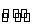 2NO2(g)(Ⅱ)
2NO2(g)(Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
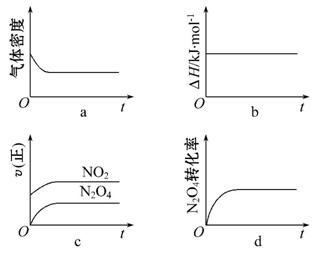
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)=____________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将____(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于中和热测定实验中的叙述不正确的是
A.应用环形玻璃搅拌棒轻轻搅动混合液
B.实验中应使用相同浓度和体积的NaOH和HCl
C.实验中两个大小不同的烧杯间要填满碎纸条,目的是减少实验过程中热量的损失
D.用相同体积的浓硫酸代替HCl溶液进行实验,测得中和热的数值比理论值偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com