
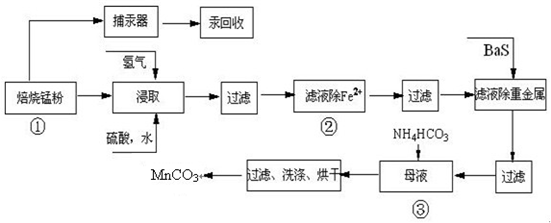
(12��) п�̷ϵ�ؾ���������������������п��̼���̣�����������ҵ��̼���̹������£�

�Իش���������
��1������Ԫ�����ڱ��е� ���ڣ��� �塣
(2)����1�Ͳ���2�ǽ�MnO2��ת��ΪMnO���������ᣬ���в���2�е�����������һ�����̲����ĸ���Ʒ����д�����������ķ�Ӧ����ʽ ��
(3) ����3�Ͳ���4���dz�����
��X��һ�֡���ɫ��������,��X��____________(�ѧʽ)��
�ڲ���3�dz�ȥ����Fe2+���������ֺͱ�Ҫ�ķ���ʽ������ȥFe2+�ķ��� (��֪�������ӳ�����pH��ΧΪFe3+��2.7��3.7��Mn2+��8.6��10.1��Fe2+��7.6��9.6 ��)
___________________________________________________________________________��
�۲���4����Ҫ��Ӧ����ʽΪ��MeSO4+BaS=MeS��+BaSO4��(Me��ҪΪPb��Cd��Hg��)�������ȥ���ʵ�ԭ����______________________________________________��
(4) ��֪���в���5�IJ���ʱ����Һ3(��Ҫ�ɷ�ΪMnSO4)�����������ɫ��ζ�����ݣ�����5��Ӧ�Ļ�ѧ����ʽΪ ��
(1)�ģ���B����1�֣���2�֣�
(2) Zn+H2SO4=ZnSO4+H2��(2��)
(3) ��H2O2 (2��)
�������������¼���˫��ˮ����Fe2+������Fe3+ ��2Fe2++ 2H2O2+ 2H+ = 2Fe3++ 2H2O
����pH��3.7-8.6��ʹFe3+������ȫ�� Fe3++ 3H2O ![]() Fe(OH)3 + 3H+ (4��)
Fe(OH)3 + 3H+ (4��)
����BaSΪ��������ʹPb2+��Cd2+��Hg+�Ƚ������ӣ����ɸ����ܵ��������ȥ��(2��)
(4)MnSO4+2NH4HCO3 = (NH4)2 SO4 +MnCO3 + H2O + CO2��(2��)



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | ���ӷ���ʽ |
| ����1��ȡ������Һ���Թ��У���������ữ��H2O2��Һ���� | 2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe2++H2O2+2H+=2Fe3++2H2O |
| ����2����pH���� 3.7��8.6 3.7��8.6 ��ʹFe3+������ȫ |
Fe3++3H2O?Fe��OH��3+3H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
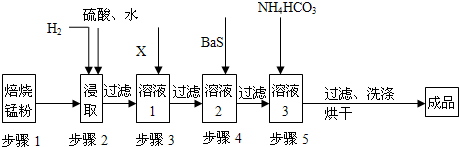
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��㶫ʡ÷���и߿���ѧһģ�Ծ��������棩 ���ͣ������
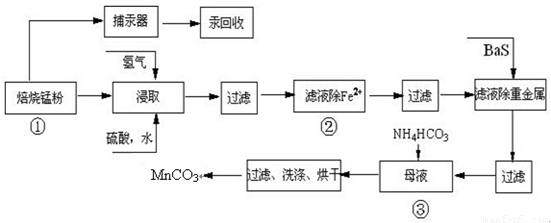
| ʵ����� | ���ӷ���ʽ |
| ����1��ȡ������Һ���Թ��У���������ữ��H2O2��Һ���� | ______ |
| ����2����pH����______��ʹFe3+������ȫ | Fe3++3H2O?Fe��OH��3+3H+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com