【答案】
分析:A.HCl是共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对;
B.碳原子的半径应比氧原子半径大;
C.碘离子电子式书写错误,应画出最外层电子数,用“[]”括起,并在右上角注明所带电荷;
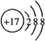
D.氯原子获得1个电子形成氯离子,氯离子质子数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8.
解答:解:A.HCl是共价化合物,不存在离子键,分子中氢原子与氯原子之间形成1对共用电子对,HCl的电子式为
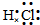
,故A错误;
B.由二氧化碳的分子式与模型可知,模型中半径较小的球表示碳原子,模型中碳原子的半径应比氧原子半径小,实际碳原子的半径应比氧原子半径大,故B错误;
C.碘离子电子式书写错误,应画出最外层电子数,用“[]”括起,并在右上角注明所带电荷,

故C错误;
D.氯原子获得1个电子形成氯离子,氯离子质子数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8,氯离子结构示意图为
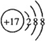
,故D正确;
故选D.
点评:本题考查常用化学用语,难度中等,注意阴离子、复杂阳离子应画出最外层电子数,用“[]”括起,并在右上角注明所带电荷.

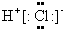
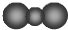
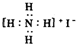
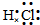 ,故A错误;
,故A错误; 故C错误;
故C错误; ,故D正确;
,故D正确;
