
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点,/℃ | 溶解度/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
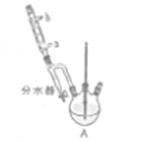
①在50mL三颈烧瓶中,加入18.5 mL正丁醇和13.4 mL冰醋酸, 3~4滴浓硫酸,投入沸石。安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)冷水应该从冷凝管 (填a或b)端管口通入。
(2)仪器A中发生反应的化学方程式为____ 。
(3)步骤①“不断分离除去反应生成的水”该操作的目的是: 。
(4)步骤②中,10%Na2CO3溶液洗涤有机层,该步操作的目的是 。
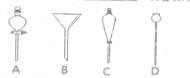
(5)进行分液操作时,使用的漏斗是 (填选项)。
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏 (填“高”或者“低”)原因是____
(7)该实验过程中,生成乙酸正丁酯的产率是 。
【知识点】有机物的制备、混合物分离、除杂J1 J2 L6
【答案解析】(1)a(1分)
(2)CH3COOH+CH3CH2CH2CH2OH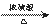 CH3COOCH2CH2CH2CH3+H2O(2分)
CH3COOCH2CH2CH2CH3+H2O(2分)
(3)使用分水器分离出水,使平衡正向移动,提高反应产率(2分);
(4)除去产品中含有的乙酸等杂质(2分)
(5)C(1分)
(6)高(1分) 会收集到少量未反应的冰醋酸和正丁醇(2分)
(7)65%(或65.1%) (2分)
解析:(1)为了保证冷凝效果冷水需要低进高出,所以应该从冷凝管a端管口通入。
(2)根据酯化反应的原理,羧基去羟基,醇去氢生成酯和水,仪器A中发生反应的化学方程式为:CH3COOH+CH3CH2CH2CH2OH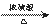 CH3COOCH2CH2CH2CH3+H2O。
CH3COOCH2CH2CH2CH3+H2O。
(3)利用减小生成物的浓度平衡正向移动,步骤①“不断分离除去反应生成的水”该操作的目的是使用分水器分离出水,使平衡正向移动,提高反应产率。
(4)步骤②中用10%Na2CO3溶液洗涤有机层,目的是除去产品中含有的乙酸等杂质。
(5)AC都是分液漏斗,A主要组装制气体的装置,进行分液操作时,使用的漏斗是C。
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,由于会收集到少量未反应的冰醋酸和正丁醇似的产率偏高。
(7)18.5 mL正丁醇的质量是18.5 mL×0.8g/mL=14.8g,13.4 mL冰醋酸的质量是13.4 mL×1.045g/mL=14g,设理论上得到乙酸正丁酯的质量是x,
CH3COOH+CH3CH2CH2CH2OH CH3COOCH2CH2CH2CH3+H2O。
CH3COOCH2CH2CH2CH3+H2O。
60g 74g 116g
14g 14.8g x
CH3COOH过量,所以x=116g×14.8g÷74g=23.2g
生成乙酸正丁酯的产率是:15.1g÷23.2g×100%=65.1%
【思路点拨】本题考查了有机物的制备、分离、除杂,产率计算,难度不大。


科目:高中化学 来源: 题型:
下列关于钢铁发生吸氧腐蚀的说法正确的是( )
A.正极上发生的电极反应是2H++2e-—→H2
B.负极上发生的电极反应是Fe2++2e-—→Fe
C.正极上发生的电极反应是2H2O+O2+4e-—→4OH-
D.最终形成黑色的铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
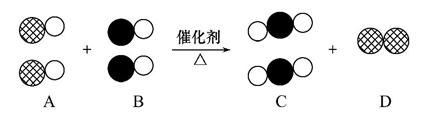
(1)A、B、C三种物质可以归为一类的依据是 。
(2)将C归为化合物,将D归为单质的理由是 。
(3)用化学反应方程式表示为 。
化学变化过程中消耗的A物质和生成的C物质的质量比为 。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)
。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图的转化关系判断下列说法正确的是(反应条件已略去)
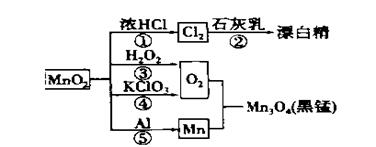
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
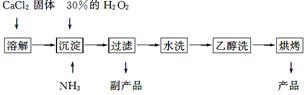
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是______________________________;
(2)检验“水洗”是否合格的方法是___________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是______________________;
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①第一步发生的反应的化学方程式为 ;
CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是研究化学的基础。关于下列各装置图的叙述中,正确的是

A.装置①常用于实验室制取氨
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可验证HCl气体在水中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图
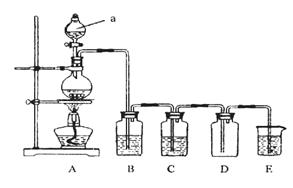
(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗0.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com